- Introduktion
- Experimentellt
- Material
- Syntes av interkalationsföreningar
- Karakterisering
- Resultat och diskussion
- XRD-karakterisering
- FTIR-spektroskopi
- Strukturell modell för Kaol/alkylamin-interkalationsföreningar
- Thermisk analys
- Kinetik för nedbrytningsreaktion
- Slutsatser
- Författarbidrag
- Intressekonfliktförklaring
- Acknowledgments
Introduktion
Design och tillverkning av lera/polymer-nanokompositer har väckt stort intresse hos både forskare och ingenjörer (Cheng et al., 2017). En mängd olika lera/polymer-nanokompositer har utvecklats och används i omfattande tillämpningar (Gogoi och Raidongia, 2017). Förinterkalering av lera följt av inkorporering av polymerer i lermineralskiktet är en allmänt antagen metod för framställning av lera/polymernanokompositer (Li et al., 2009; Zare et al., 2017). Medan de interkaleras i oorganiska lerlager minskar organiska polymerkedjor naturligt sin strukturella rörlighet och vissa av dem antar en mycket organiserad konformation inom den skiktade strukturen.
I naturen är kaolinit (Kaol) en typ av lermineral med en 1:1 dioktaedrisk aluminiumsilikatskiktsstruktur (Brindley och Robinson, 1945). Lagren i Kaol hålls samman av vätebindningar, dipol-dipolinteraktioner och van der Waals-krafter (Brindley et al., 1967). Endast ett begränsat antal mycket polära organiska arter, inklusive urea (Makó et al., 2009), dimetylsulfoxid (Costanzo och Giesse, 1986), formamid (Frost et al., 2000a), hydrazin (Cruz och Franco, 2000) och kaliumacetat (Frost et al., 2000b), har lyckats interkaleras i Kaols galleri. Interkalering av små molekyler i Kaol-skikten orsakar en ökning av basalavståndet och kan användas som ett preliminärt expansionssteg för efterföljande insättning av stora, icke-reaktiva arter genom förskjutning av de förinterkalerade små molekylerna (Cheng et al., 2015). Baserat på tidigare rapporter kan till exempel en interkalationsförening av Kaol/metanol vara en effektiv intermediär för ytterligare interkalationsreaktioner med etylenglykol (Hirsemann et al., 2011), hexylamin (Matusik et al., 2012), n-alkylaminer (Gardolinski och Lagaly, 2005) och kvaternära ammoniumsalter (Cheng et al., 2016). Dessutom är majoriteten av gästmolekylerna svåra att infogas i mellanskiktsutrymmet, en av orsakerna är de starka vätebindningarna, en annan är att det inte finns några utbytbara joner i Kaol-strukturen.
Och även om lera/polymer-nanokompositer har utvecklats väl under de senaste åren, är det fortfarande en stor utmaning att syntetisera nya lera/organiska nanokompositer för potentiell tillämpning (Kotal och Bhowmick, 2015). För att lösa detta problem är det verkligen brådskande att ta reda på processen i nanoskala för interkalering av kaolinit och göra en grundlig undersökning av nedbrytningsmekanismen med modern teknik och analytiska verktyg. Termisk analys och kinetisk beräkning av interkalationsföreningar av lera/polymerer kan bidra till att karaktärisera nedbrytningsprocesserna och ge vetenskaplig grund för kontroll av interkalationsreaktioner (Zhang et al., 2015). De kinetiska parametrarna för nedbrytningsreaktionens kinetiska process, såsom aktiveringsenergi, preexponential, reaktionsordningar och hastighetskonstant bedömdes med hjälp av data från termogrammen för lera/polymer. I denna studie undersöktes interkalationen av Kaol med olika alkylaminer. Dessutom undersöktes interkaleringsprocessen och nedbrytningsmekanismen systematiskt.
Experimentellt
Material
Kaolin som användes i den här studien utnyttjades från Zhangjiakou, Kina. Den huvudsakliga mineralsammansättningen är en välordnad kaolinit (95 % i massa). Den maldes för att passera en 325-maskig sikt (partiklar som mäter < 44 μm) före interkalering. Alkylamin hexylamin (HA, 99 %), dodecylamin (DA, kemiskt rent) och oktadekylamin (OA, kemiskt rent) köptes från Nanjing Shuguang Chemical Company, Kina. Dimetylsulfoxid (DMSO, analytiskt reagens), metanol (MeOH, analytiskt reagens) och toluen (99 %) erhölls från Xilong Chemical Company, Kina, och användes i befintligt skick utan ytterligare rening. Den kemiska formeln och strukturformeln för HA, DA och OA visas i tabell 1.

Tabell 1. Kemisk och strukturell formel för HA, DA och OA.
Syntes av interkalationsföreningar
Först framställdes Kaol/DMSO-interkalationsföreningen genom att 20,0 g Kaol dispergerades i en blandning av 36,0 g DMSO och 4,0 g vatten. Blandningen rördes i ett vattenbad i 2 timmar vid 95 °C och sedan separerades suspensionen genom centrifugering med etanol. För det andra användes Kaol/DMSO-interkalationsföreningen som en prekursor för ytterligare reaktion med MeOH. MeOH tillsattes till den förinterkalerade Kaol och reaktionsblandningen rördes om i 10 dagar, varvid MeOH ersattes varje dag med samma mängd färsk MeOH. Utfällningen i blandningen separerades genom centrifugering och torkades i en ugn vid 60 °C i 12 timmar för att erhålla interkalationsföreningar av Kaol/MeOH. Slutligen blandades 2 g Kaol/MeOH-interkalationsförening med 30,0 ml HA-, DA- eller OA-metanollösningar (1 mol/L) under omrörning i rumstemperatur. Dispersionerna centrifugerades efter reaktion i 24 timmar. Sedimenten tvättades tre gånger med toluen för att avlägsna överskott av HA, DA eller OA. Proverna torkades vid rumstemperatur i 12 timmar och maldes till pulver med en agatmortel (Komori et al., 1999). De resulterande föreningarna är märkta som Kaolpi/HA (pi som förinterkalerad), Kaolpi/DA och Kaolpi/OA.
Karakterisering
XRD-mönstren registrerades på en Rigaku D/max 2500PC röntgendiffraktometer med Cu Kα-strålning (λ = 1,54178 Å) som arbetar vid 40 kV och 150 mA. De slumpmässigt orienterade provproverna skannades i 2θ-området mellan 1 och 20° med en hastighet av 2° min-1. En Thermo Fisher Nicolet 6700 spektrofotometer användes för att registrera FTIR-spektra inom området 4 000~400 cm-1. TG-DSC-analyserna utfördes med en Mettler-Toledo TG-DSC I/1600 HT simultan termisk analysator under kväveatmosfär. Tjugo milligram av provet placerades i en aluminiumoxiddegel och värmdes från 30 till 1100°C med en serie uppvärmningshastigheter på 4, 6, 8, 10°C min-1.
Resultat och diskussion
XRD-karakterisering
XRD-mönstren för den orörda Kaol och dess interkalationsföreningar visas i figur 1. Mönstret för den orörda Kaol visar en välordnad skiktstruktur med ett basalavstånd på 0,71 nm. Detta värde stämmer väl överens med ICDD:s standardreferensmönster 14-0164 . Efter behandling med DMSO uppstod en ny basal reflektionstopp vid 1,14 nm, vilket tyder på att DMSO framgångsrikt fördes in i Kaols mellanskikt. Efter att Kaol/DMSO-interkalationsföreningen behandlades med MeOH försköts den 1,14 nm (001) karakteristiska reflektionen för Kaol/DMSO-interkalationsföreningen till 0,86 nm. Matusik et al. (2012) rapporterade att Kaol/DMSO/MeOH-föreningen torkades vid 110 °C, reflektionen med d = 1,12 nm försvann och en bred reflektion med maximum vid 0,95 nm observerades. Baserat på den kemiska formeln Al2Si2O5(OH)3.20(OCH3)0.80 för Kaol/DMSO-interkalationsförbindelsen som har beräknats enligt basen av CHNSanalysen, visade det sig att ungefär 1/3 av OH-grupperna på den inre ytan ersattes av metoxygrupper, och denna observation tyder också på att det har bildats en Kaol/MeOH-interkalationsförbindelse (Tunney och Detellier, 1996; Cheng et al., 2015). XRD-mönstren visar också att Kaol/MeOH-föreningarna som interkaleras med HA, DA och OA expanderar strukturen längs c-axeln, vilket leder till ett stort mellanskiktsavstånd på 2,86, 4,08 respektive 5,66 nm. Längden på HA:s, DA:s och OA:s molekylkedjor är 1,56, 2,51 respektive 3,65 nm (McNulty et al., 2011, 2014). Sammantaget ökade mellanskiktsavståndet för interkalationsföreningarna Kaol/alkylamin med alkylaminernas alkylkedjelängd, men alkylaminmolekylen är inte en enkelskikts- eller tvåskiktsstruktur som är vinkelrät mot Kaol-ytan.
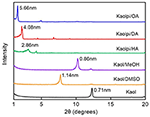
Figur 1. XRD-mönster av Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA och Kaolpi/OA.
FTIR-spektroskopi
FTIR-spektroskopi har använts i stor utsträckning för att karakterisera interkalationsföreningar (Ledoux och White, 1964; Frost et al., 2000c; Cheng et al., 2012). FTIR-spektra för de ursprungliga Kaol-, Kaolpi/HA-, Kaolpi/DA- och Kaolpi/OA-interkalationsföreningarna visas i figur 2. De karakteristiska banden vid 432, 470 och 541 cm-1 (figur 2B) tillhör deformationsläget för Si-O, Si-O-Si och Al-O-Si. De andra banden vid 1 009, 1 031 och 1 114 cm-1 (figur 2C) är hänförda till Si-O-Sis sträckningsvibrationer i Kaol-skiktet. Om man jämför spektrat för Kaol och dess interkalationsföreningar har bandens position ingen uppenbar variation, vilket tyder på att dessa band för sträckningsvibrationer inte påverkas av de interkalerade molekylerna.
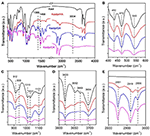
Figur 2. Infrarödspektrum för Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Banden vid 912 och 938 cm-1 (figur 2C) tillhör OH-deformationen av inre hydroxylgrupper och hydroxylgrupper på den inre ytan. Det finns fyra tydliga hydroxylsträckningsband vid 3 694, 3 669, 3 652 och 3 620 cm-1 (figur 2D) i spektrumet från den ursprungliga Kaol, banden vid 3 694, 3 669 och 3 652 cm-1 orsakas av hydroxylgrupperna på den inre ytan, medan det vid 3 620 cm-1 beror på de inre hydroxylgrupperna (Farmer, 1964; Ledoux och White, 1964; Giese och Datta, 1973). Efter interkalering av alkylaminmolekyler försvagades vissa band på grund av förändrade interaktioner med närliggande atomer. Förskjutningen till 3 697 cm-1 och minskningen av intensiteten hos bandet vid 3 694 cm-1 tyder på att många hydroxylgrupper i Kaol deltog och bildade vätebindningar med amingrupperna i alkylaminmolekylerna (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
Närvaron av alkylaminmolekyler i mellanskiktet detekterades på FTIR-spektrumet genom de nya topparna, som visas i figurerna 2A, E. För interkalationsföreningarna finns några uppenbara karakteristiska toppar som bandet vid 1 388 och 1 468 cm-1 som tillhör C-H-böjningsläget för -CH3 respektive -CH2. Ett nytt vibrationsband vid 3 334 cm-1 observerades, vilket beror på sträckningsläget för N-H-sträckningsvibrationen (Griffiths och De Haseth, 2007; Zhang et al., 2018). Det nya vibrationsbandet vid 2 956 cm-1 observerades och tilldelas vanligtvis det asymmetriska C-H-sträckningsbandet för de terminala metylgrupperna (Cheng et al., 2016). De två vibrationsbanden vid 2 919 och 2 851 cm-1 tilldelas vanligtvis de symmetriska och asymmetriska sträckningsvibrationerna hos -(CH2)n- (Venkataraman och Vasudevan, 2001). Bandens intensitet ökar gradvis, vilket innebär att fler alkylaminkolatomer har infogats i Kaol interlayers. Dessutom kommer alkylaminernas flyktighet att minska med ökningen av kolkedjan, så stabiliteten hos motsvarande Kaol-interkalationsföreningar kommer gradvis att öka med större alkylaminmolekylmassa (Wang et al., 2010).
Strukturell modell för Kaol/alkylamin-interkalationsföreningar
Arrangemanget av interkalerade molekyler är grunden för den experimentella analysen av strukturen för Kaol/alkylamin-interkalationsföreningar. Enligt Lagaly (1981) kan strukturmodellerna för interkalationsföreningar av montmorillonit-kvartära ammoniumsalter delas in i tre kategorier: (a) monolager: kortkedjiga alkylaminjoner, (b) bilager: långkedjiga kvaternära ammoniumjoner, (c) tre lager: knutna alkylkedjor i högt laddade lermineraler. Beneke och Lagaly (1982) föreslog vidare olika strukturer för de interkalerade alkylaminmolekylerna baserat på XRD, vilka sammanfattas enligt följande: (a) alkylkedjorna i mellanskiktsutrymmet är lutande mot (001) kristallplanet, (b) alkylkedjorna är arrangerade i tvåskikt. Brindley och Moll (1965) beskrev att de interkalerade molekylerna lutar mot silikatskikten i ett enskilt lager, medan vinkeln är ca 65° mot (001) kristallplanet. Om de interagerande molekylerna är enhetligt fästade vid alla silikatytor med hjälp av de aktiva hydroxylgrupperna, föreslås en ”end to end”-organisation i par med en viss longitudinell förskjutning. Lutningsvinkeln stämmer överens med det möjliga nära packningssättet mellan silikatets syreytor och de terminala hydroxylgrupperna och graden av nära packning av kedjemolekylerna sinsemellan.
Alkylmolekylerna är svåra att interkalera direkt i de ursprungliga Kaol-skikten eftersom det saknas utbytbara joner i Kaols mellanskiktsutrymme. Giltiga prekursorer är nödvändiga för att alkylaminmolekylerna ska kunna infogas i Kaols mellanskikt. Det rapporterades att alkyltrimetylammoniumkloridkedjan bildar ett lutande bilager i Kaols mellanskikt och lutningsvinkeln är ~36° efter beräkning (Kuroda et al., 2011). Yuan et al. (2013) påpekade att det strukturella arrangemanget av de kvartära ammoniumsaltmolekylerna i Kaols mellanskikt lutar till tvåskiktet och att lutningsvinkeln är ~38,4°. Gardolinski och Lagaly (2005) föreslog att alkylkedjorna i mellanskikten är helt utsträckta och orienterade vinkelrätt mot Kaol-ytan av tvåskiktet. Genom att analysera längden på HA-, DA- och OA-molekylernas kedjor kan man därför dra slutsatsen att det basala avståndet efter interkalering inte är tillräckligt för att alkylkedjorna ska kunna komma in vertikalt och i tvåskikt. En ytterligare analys av XRD-resultaten visar att alkylkedjorna i HA, DA och OA lutar mot Kaol-ytan i tvåskiktet och att alkylkedjornas lutningsvinkel är cirka 39,9, 39,9 respektive 41,1°. På grund av hydroxylbindningen mellan hydroxyl på den inre ytan i Kaol och amingrupper i alkylaminmolekylerna visas dessutom den mest möjliga strukturella modellen för interkalationsföreningarna mellan Kaol och alkylamin i figur 3.
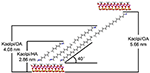
Figur 3. Den mest möjliga strukturmodellen för interkalationsföreningarna av kaolinit/alkylamin.
Thermisk analys
TG-DSC-analysresultaten av Kaol och dess interkalationsföreningar visas i figur 4. Den största massförlusten av Kaol är den mellan 400 och 600 °C med den maximala förlusthastigheten vid 525 °C som tillskrivs vattenförlusten på grund av dehydroxylering av kristallgitteret, vilket resulterar i bildandet av metakaolinit (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Denna förlust motsvarar cirka 12,7 % av den totala massan, vilket ligger extremt nära den teoretiska referensen (13,9 %). Genom att jämföra TG-DSC-kurvorna för den ursprungliga Kaol observeras två huvudsakliga massförluststeg i interkalationsföreningarna Kaolpi/HA, Kaolpi/DA och Kaolpi/OA. Det första inträffade mellan 150 och 350 °C, vilket beror på nedbrytning av de interkalerade alkylaminmolekylerna (Yuan et al., 2013). Den andra inträffade vid cirka 500 °C och beror på dehydroxylering av den avinterkalerade Kaol. För Kaolpi/OA interkalierades en del OA in i silikatets mellanskiktsutrymme för att bilda en stabil interkalering, vilket kan bevisas av XRD-mönstret. Vissa molekyler är intrasslade i varandra på grund av den långa kedjan eller en klämma i nanorullarna som inte helt kan avlägsnas (Li et al., 2015; Liu et al., 2016). Vid 220 °C beror den tydliga massförlusten på nedbrytning av den belagda eller obundna OA, medan massförlusten vid 330 °C tillskrivs nedbrytningen av interkalierad OA. Den exoterma toppen vid 996°C är resultatet av omkristallisering av Kaol.
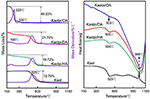
Figur 4. TG-DSC-kurvor för Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Vid jämförelse av TG-DSC-kurvorna för den ursprungliga Kaol och interkalationsföreningar av Kaol/alkylamin (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA) kan man observera: (a) Den har olika massaförluststeg, liksom en betydande skillnad i massaförlusterna mellan Kaolpi/OA och de andra två interkalationsföreningarna (Kaolpi/HA, Kaolpi/DA). Massförlusten för nedbrytningen av Kaolpi/HA och Kaolpi/DA var ca 20 %, men mängden av de två massförlusterna för Kaolpi/OA är ca 50 %. Detta kan bero på att en större mängd OA interkalierades i silikatets mellanskiktsutrymme än HA och DA (Wang et al., 2017). (b) Dehydroxyleringstemperaturen för interkalationsföreningarna var lägre än för den ursprungliga Kaol med cirka 20 °C. Detta beror på att interkalationsmolekylerna utvidgade mellanskiktsavståndet, försvagade vätebindningarna mellan Kaol-skikten, vilket medförde en enklare dehydroxylering från Kaol-ytan. Kaolens kristallinitet minskade därför kraftigt efter interkalering, vilket kan bekräftas av XRD och IR (under 800 cm-1). Detta resultat stämmer överens med slutsatsen i vissa andra rapporter att temperaturen för dehydroxylering bestämdes av Kaols kristallinitet (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Kinetik för nedbrytningsreaktion
Nedbrytningskinetiken för interkalationsförbindelsen av Kaol/alkylamin undersöktes med termogravimetri. De kinetiska parametrarna (aktiveringsenergi E och preexponentialfaktorn A) för nedbrytningsprocessen beräknades med hjälp av KAS- och Ozawametoderna (Kissinger, 1957; Škvára och Šesták, 1975). Den termiska nedbrytningsmekanismen för interkalationsföreningen Kaol/alkylamin studerades med Satava-integralmetoden (Xie et al., 2001; Gao et al., 2005; Zhang et al, 2015).
Enligt reaktionsteorin uttrycks den icke-isotermiska nedbrytningskinetiska formeln vanligen enligt följande:
där α är omfattningen av omvandlingshastigheten för B(s) vid tiden t, f (α) är reaktionsmekanismens funktion och k är reaktionshastighetskonstanten. k lyder följande ekvation:
Om provets temperatur regleras med en konstant uppvärmningshastighet (β = dT/dt) kan reaktionshastigheten definieras enligt följande:
Efter att ha separerat variabeln kan omarrangemang med integral- eller differentialfunktioner av ekvation (4), KAS-ekvation (5) och Ozawas ekvation (6) beräknas enligt följande:
Varvid G(α) representerar omvandlingens integralfunktion. På grund av den integrala approximationen användes iterativa metoder för att beräkna E för att undvika vissa avvikelser. Funktionerna för iterativa metoder är följande:
Sätt x = E/RT, definitionen av h(x) och H(x) är:
Iterationen är som följande tre steg:
(a) Ställ in h(x) = 1 eller H(x) = 1, beräkna E0 med hjälp av minsta kvadratmetoden i enlighet med lutningen av det linjära sambandet lnβ/T2 och lnβ till 1/T.
(c) Ersätt E0 med E1, upprepa steg (b) tills Ei-Ei-1 < 0. 1 kJ mol-1. Ei är det exakta värdet av aktiveringsenergin för nedbrytningsreaktionen.
E-värdena för interkalationsföreningar av Kaol/alkylamin beräknades med KAS, Ozawa och iterativa metoder (tabell 2). De beräknade resultaten som erhölls med KAS-metoden låg närmare resultaten från iterativa metoder, men resultaten från den iterativa metoden Ozawa visade större avvikelse än andra. Därför kan den genomsnittliga E från iterativa metoder betraktas som aktiveringsenergi för nedbrytningsreaktionen eftersom de är en förbättring jämfört med KAS- och Ozawa-metoderna. Den genomsnittliga E för Kaolpi/HA, Kaolpi/DA och Kaolpi/OA är 104,44, 130,80 och 154,59 kJ mol-1. Man kan se att den genomsnittliga E bland Kaol/alkylaminföreningar har en positiv korrelation med alkylkedjelängden. En av orsakerna är att volatiliteten försvagas när alkylkedjan växer. En annan orsak är att Kaolpi/OA har den bästa välordnade interkalationsstrukturen som är svårast att avinterkalera. Och dessa resultat kan bekräftas av XRD-mönster.
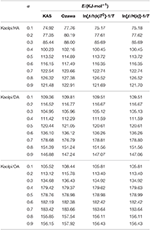
Tabell 2. E av Kaol/alkylamin interkalationsföreningar med olika α beräknat med KAS, Ozawa och iterationsmetoder.
Funktionerna och A för nedbrytningsreaktionsmekanismen beräknades med Satava-metoderna, som beskrevs enligt följande:
Substituera α i varje mekanismfunktion G(α) för att erhålla värdet av lg, linjär anpassning lg och 1/T som motsvarar uppvärmningshastigheten, den funktion som har den största anpassningen kan bestämmas som den mest sannolika mekanismfunktionen. Och värdena för E och A kan erhållas genom lutningen och interceptet för en linjär anpassningskurva.
Som framgår av tabell 3 väljs fem mekanismfunktioner med en passningsnoggrannhet på över 90 % ut baserat på Satava-integralformeln. Genom att jämföra de fem funktionerna kan mekanismfunktion nr 9 G(α) = 2 med en passningsnoggrannhet på 97 % betraktas som den mest sannolika mekanismfunktionen, och de linjära anpassningskurvorna för funktion nr 9 visas i figur 5. E och A ligger också inom det normala intervallet för nedbrytningskinetiken. Nedbrytningsmekanismfunktionerna för de tre interkalationsföreningarna av Kaol/alkylamin anges i tabell 4.

Tabell 3. Utvalda kinetiska mekanismfunktioner bedömda med Satava integralmetod.

Figur 5. Linjära anpassningskurvor för funktion nr 9 bedömd med Satava-integralmetoden.

Tabell 4. Kinetiska mekanismfunktioner för interkalationsföreningar av kaol/alkylamin.
Slutsatser
De möjliga strukturmodellerna och nedbrytningskinetiken för interkalationsföreningar av kaol/alkylamin har undersökts med hjälp av XRD, FT-IR och TG-DSC. Interkalationen av Kaol/MeOH-föreningen med HA, DA och OA utökar Kaols mellanskiktsavstånd längs c-axeln, vilket resulterar i att den dominerande reflektionen uppträder vid 2,86, 4,08 respektive 5,66 nm. Dessutom är basalavståndet efter interkalering inte tillräckligt för att alkylkedjan ska kunna komma in vertikalt i ett och två lager. Man drog slutsatsen att alkylkedjorna i HA, DA och OA lutar mot Kaol-ytan i tvåskiktet och att alkylkedjornas lutningsvinkel är ~40°.
Baserat på KAS-, Ozawa- och iterativa metoder beräknades resultaten av aktiveringsenergin E för interkalationsföreningar av Kaol/alkylamin. Den genomsnittliga aktiveringsenergin E för Kaolpi/HA, Kaolpi/DA och Kaolpi/OA är 104,44, 130,80 och 154,59 kJ mol-1. Den genomsnittliga aktiveringsenergin E bland Kaol/alkylaminföreningar har en positiv korrelation med alkylkedjans längd. Den optimerade mekanismfunktionen för Kaol/alkylamin-nedbrytningsprocessen bestämdes som en 3D-diffusion med integralfunktionen G(α) = 2. Denna forskning är fördelaktig för att bättre förstå nedbrytningsmekanismen för lera/organiska nanokompositer förutom att ge inspiration till att syntetisera nya lerbaserade material.
Författarbidrag
HC och QfL utformade experimentet och reviderade artikeln. YZ, QhL och PX utförde experimenten och skrev artikeln. YZ och QhL bidrog lika mycket till detta arbete.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Dr. Luyi Sun (Department of Chemical and Biomolecular Engineering and Polymer Program, Institute of Materials Science, University of Connecticut) tackas för att ha reviderat artikeln. Författarna är tacksamma för det ekonomiska stödet från National Natural Science Foundation of China (41602171), Beijing Natural Science Foundation (8164062) och Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing.
Giese, R., and Datta, P. (1973). Hydroxylorientering i kaolinit, dickit och nakrit. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). Fouriertransform infrarödspektrometri. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K. och Guggenheim, S. (1985). Dehydroxylering av kaolinit. Am. Mineral. 70, 1-2.
Google Scholar
Lämna ett svar