14.8 Etrar
Lärandemål
- Beskriv den strukturella skillnaden mellan en alkohol och en eter som påverkar deras fysikaliska egenskaper och reaktivitet.
- Nämn enkla etrar.
- Beskriv struktur och användningsområden för vissa etrar.
Med den allmänna formeln ROR′, en eterEn organisk förening som har en syreatom mellan två kolvätegrupper. kan betraktas som ett derivat av vatten där båda väteatomerna är ersatta med alkyl- eller arylgrupper. Den kan också betraktas som ett derivat av en alkohol (ROH) där väteatomen i OH-gruppen har ersatts av en andra alkyl- eller arylgrupp:
HOH→H-atomerersätt bådaROR′←′av OH-gruppenersätt H-atomROH
Enkla etrar har enkla gemensamma namn som bildas av namnen på de grupper som är knutna till syreatomen, följt av det generiska namnet eter. CH3-O-CH2CH2CH2CH3 är till exempel metylpropyleter. Om båda grupperna är desamma ska gruppnamnet föregås av prefixet di-, som i dimetyleter (CH3-O-CH3) och dietyleter CH3CH2-O-CH2CH3.
Etermolekyler har ingen väteatom på syreatomen (det vill säga ingen OH-grupp). Därför finns det ingen intermolekylär vätebindning mellan etermolekyler, och etrar har därför ganska låga kokpunkter för en given molarmassa. Etrar har faktiskt ungefär samma kokpunkter som alkaner med jämförbar molarmassa och mycket lägre än motsvarande alkoholer (tabell 14.4 ”Comparison of Boiling Points of Alkanes, Alcohols, and Ethers”).
Tabell 14.4 Jämförelse av kokpunkterna för alkaner, alkoholer och etrar
| Kondenserad strukturformel | Namn | Molarmassa | Kokpunkt (°C) | Intermolekylär vätebindning i ren vätska? |
|---|---|---|---|---|
| CH3CH2CH3 | propan | 44 | -42 | nej |
| CH3CH3OCH3 | dimetyleter | 46 | -25 | nej |
| CH3CH2OH | etylalkohol | 46 | 78 | ja |
| CH3CH2CH2CH2CH3 | pentan | 72 | 36 | nej |
| CH3CH2OCH2CH3 | dietyleter | 74 | 35 | nej |
| CH3CH2CH2CH2CH2OH | butylalkohol | 74 | 117 | ja |
Etermolekyler har en syreatom, och har vätebindning med vattenmolekyler. Följaktligen har en eter ungefär samma löslighet i vatten som den alkohol som är isomer med den. Till exempel är dimetyleter och etanol (båda med molekylformeln C2H6O) helt lösliga i vatten, medan dietyleter och 1-butanol (båda med molekylformeln C4H10O) knappt är lösliga i vatten (8 g/100 ml vatten).
Exempel 5
Vilket är det vanliga namnet på varje eter?
- CH3CH2CH2OCH2CH2CH2CH3
-
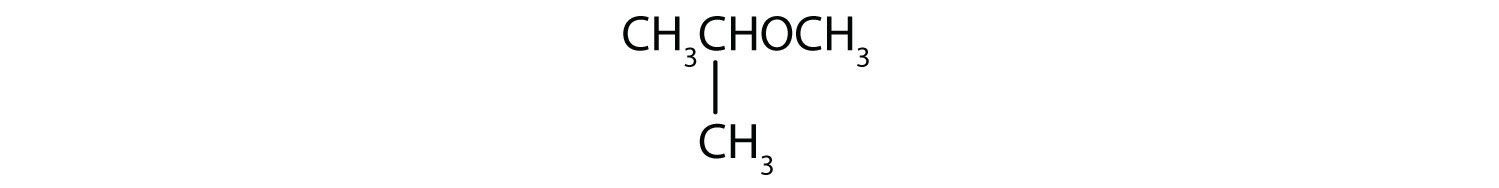
Lösning
- Kolvätegrupperna på vardera sidan om syreatomen är propylgrupper (CH3CH2CH2), så föreningen är dipropyleter.
- Den trekoliga gruppen är bunden av den mittersta kolatomen, så det är en isopropylgrupp. Den ena kolgruppen är en metylgrupp. Föreningen är isopropylmetyleter.
Skillbuilding Exercise
-
CH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3
-
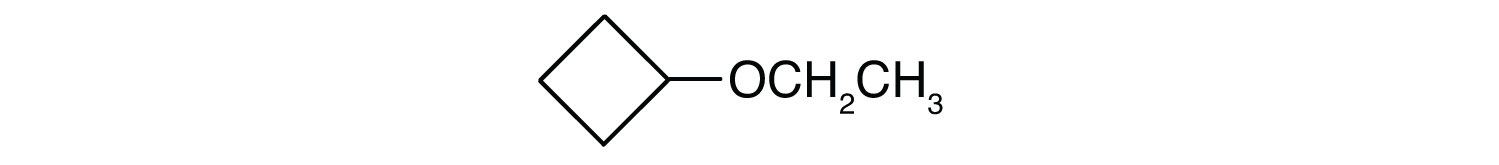
Vad är det vanliga namnet för varje eter?
Till din hälsa: Eter som allmänna bedövningsmedel
Ett allmänt bedövningsmedel verkar på hjärnan för att framkalla medvetslöshet och en allmän okänslighet för känslor eller smärta. Dietyleter (CH3CH2OCH2CH3) var det första allmänna bedövningsmedel som användes.
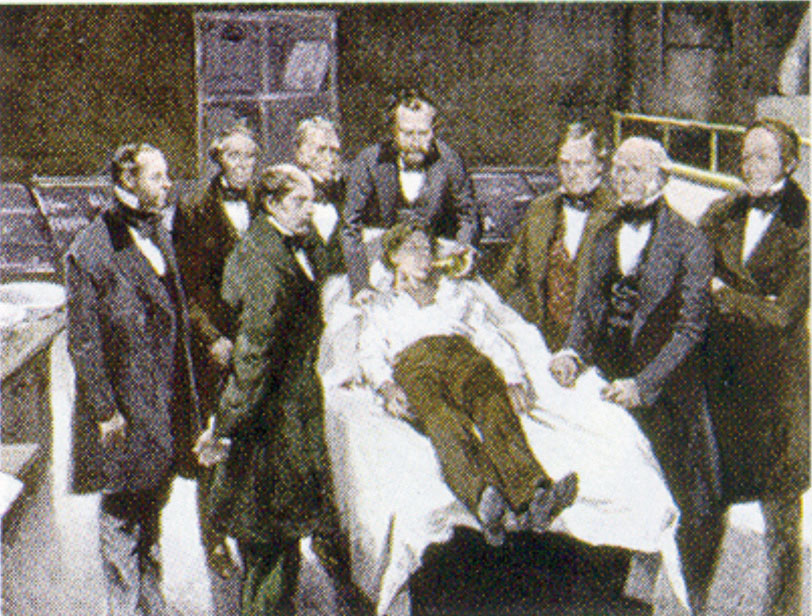
William Morton, en tandläkare från Boston, introducerade dietyleter i kirurgisk praxis 1846. Den här målningen visar en operation i Boston 1846 där dietyleter användes som bedövningsmedel. Inandning av eterångor ger medvetslöshet genom att trycka ner aktiviteten i det centrala nervsystemet.
Källa: Bild: Målning av William Morton av Ernest Board, från http://commons.wikimedia.org/wiki/File:Morton_Ether_1846.jpg.
Dietyleter är relativt säkert eftersom det finns en ganska stor skillnad mellan den dos som ger en effektiv bedövningsnivå och den dödliga dosen. Eftersom den är lättantändlig och har den ytterligare nackdelen att den orsakar illamående har den dock ersatts av nyare inhalationsbedövningsmedel, däribland de fluorhaltiga föreningarna halotan, enfluran och isofluran. Tyvärr har säkerheten hos dessa föreningar för operationspersonal ifrågasatts. Till exempel drabbas kvinnlig personal i operationssalar som utsätts för halotan av fler missfall än kvinnor i den allmänna befolkningen.
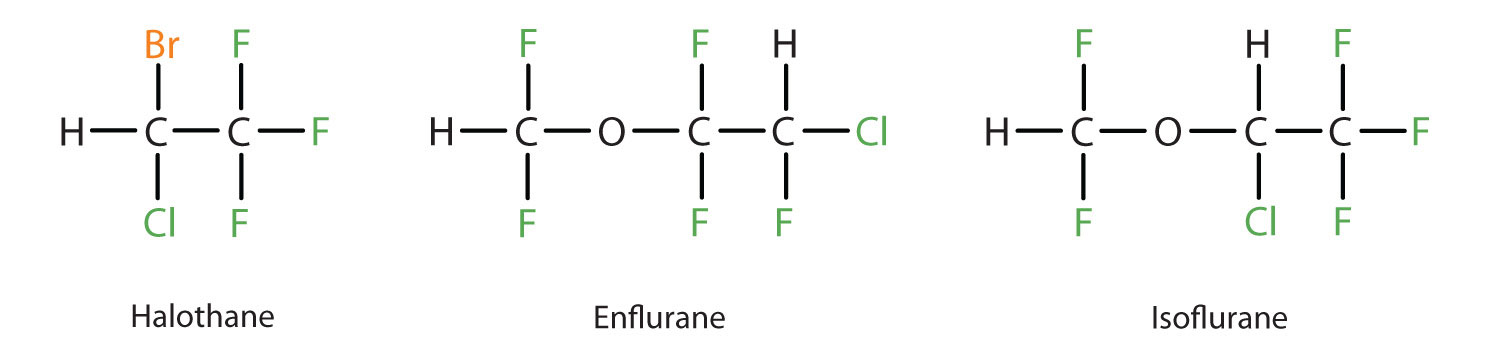
Dessa tre moderna inhalationsanestetiska föreningar som innehåller halogener är mindre lättantändliga än dietyleter.
Övningar för begreppsgenomgång
-
Varför har dietyleter (CH3CH2OCH2CH3) en mycket lägre kokpunkt än 1-butanol (CH3CH2CH2CH2OH)?
-
Vad är mer lösligt i vatten – etylmetyleter (CH3CH2OCH3) eller 1-butanol (CH3CH2CH2CH2CH2OH)? Förklara.
Svar
-
Dietyleter har ingen intermolekylär vätebindning eftersom det inte finns någon OH-grupp; 1-butanol har en OH-grupp och deltar i intermolekylär vätebindning.
-
Etylmetyleter (tre kolatomer, en syreatom) är mer löslig i vatten än 1-butanol (fyra kolatomer, en syreatom), även om båda kan inleda vätebindning med vatten.
Nyckelresultat
- För att ge etrar vanliga namn, namnge helt enkelt de grupper som är knutna till syreatomen, följt av det generiska namnet eter. Om båda grupperna är desamma ska gruppnamnet föregås av prefixet di-.
- Etermolekyler har ingen OH-grupp och därmed ingen intermolekylär vätebindning. Etrar har därför ganska låga kokpunkter för en given molarmassa.
- Etermolekyler har en syreatom och kan engagera sig i vätebindning med vattenmolekyler. En etermolekyl har ungefär samma löslighet i vatten som den alkohol som är isomer med den.
Övningar
-
Hur kan etanol ge två olika produkter vid upphettning med svavelsyra? Namnge dessa produkter.
-
Vilken av dessa etrar är isomer med etanol-CH3CH2OCH2CH3, CH3OCH2CH3 eller CH3OCH3?
-
Nämn varje förening.
- CH3OCH2CH2CH2CH3
-
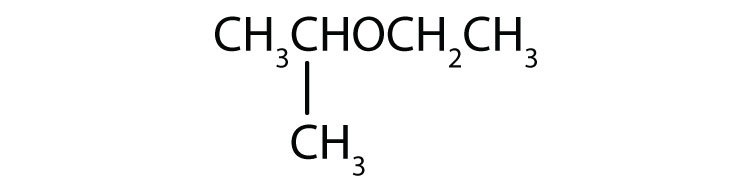
-
Nämn varje förening.
- CH3CH2CH2CH2OCH3
- CH3CH2OCH2CH2CH2CH3
-
Rita strukturen för varje förening.
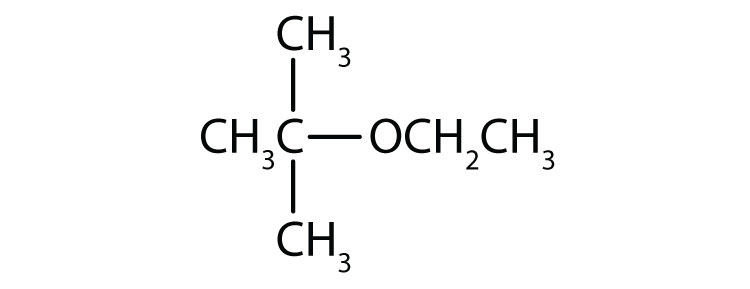
- metyletyletyleter
- tert-butyletyleter
-
Rita strukturen för varje förening.
- diisopropyleter
- cyklopropylpropyleter
Svar
-
Intramolekylär (både H och OH kommer från samma molekyl) dehydrering ger eten; Intermolekylär (H kommer från en molekyl och OH kommer från en annan molekyl) dehydrering ger dietyleter.
-
- metylpropyleter
- etylisopropyleter
.
-
- CH3OCH2CH3
-
Lämna ett svar