- Vad är järn
- Var finns järn
- Historia
- Identifiering
- Klassificering, Egenskaper och egenskaper hos järn
- Allmänna egenskaper
- Fysikaliska egenskaper
- Kemiska egenskaper
- Atomdata för järn (grundämne 26)
- Vad är de vanligaste användningsområdena för järn
- Har grundämnet några toxiska effekter
- Interessanta fakta
- Järnmetallpris
Vad är järn
Järn (uttalat som EYE-ren) är en hårdmetall med ett högt kommersiellt värde som tillhör familjen av övergångsmetaller. Den representeras av den kemiska symbolen Fe och är kemiskt reaktiv med en tendens att lätt korrodera i luft och bildar ett rödaktigt lager som kallas rost när den utsätts för fuktig luft .

Järnsymbol
Var finns järn
Det är den fjärde vanligaste metallen i jordskorpan, vanligen förknippad med andra mineraler som hematit, takonit och magnetit som finns i gruvreserver i Ukraina, Brasilien, Ryssland, Australien och Kina. Den kommersiella framställningen sker i en masugn genom upphettning av malmen med koks och kalksten .
Historia
Namnets ursprung: Namnet på grundämnet kommer från ett anglosaxiskt ord ”järn”.
Vem upptäckte det:
Vem upptäckte det? Omkring 3500 f.Kr. trodde man att egyptierna använde järnföremål. Hettiter från Mindre Asien var kända för att smälta metallen från dess malm under 1500 f.Kr. År 1722 publicerade René Antoine Ferchault de Réaumur, en fransk entomolog, en bok där han beskrev betydelsen av olika järnlegeringar.

Järnmetall
Identifiering |
|||
| Atomnummer | 26 | ||
| CAS-nummer | 7439-89-6 | ||
| Position i det periodiska systemet | Grupp | Period | Block |
| 8 | 4 | d | |
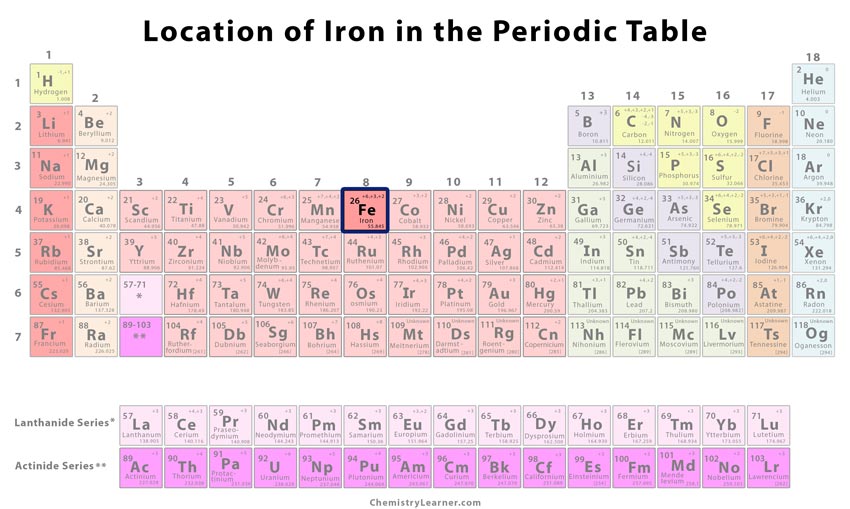
Var finns järn i det periodiska systemet
Klassificering, Egenskaper och egenskaper hos järn
Allmänna egenskaper |
||
| Relativ atommassa | 55.845 | |
| Atommassa/vikt | 55.845 atommasseenheter | |
| Molarmassa/molekylvikt | 55.845 g/mol | |
| Massanummer | 56 | |
Fysikaliska egenskaper |
||
| Färg/fysiskt utseende | Silvrigt grått | |
| Smältpunkt/fryspunkt | 1538°C (2800°F) | |
| Kokpunkt | 2861°C (5182°F) | |
| Densitet | 7.87 g/cm3 | |
| Standard/naturligt tillstånd vid rumstemperatur (fast/flytande/gas) | Fasta | |
| Målbarhet | Ja | |
| Duktilitet | Ja | |
| Hårdhet | 4-5 Mohs | |
| Specifik värmekapacitet | 0.444 J g-1 oC | |
| Värmeledningsförmåga | 80.4 Wm-1K-1 | |
Kemiska egenskaper |
||
| Brännbarhet | Inte brännbart | |
| Oxideringstillstånd (siffror) | 6, 3, 2, 0,-2 | |
Atomdata för järn (grundämne 26)
| Elektronkonfiguration (ädelgaskonfiguration) | 3d64s2 | ||||||
| Atomstruktur | |||||||
| – Antal elektroner | 26 | ||||||
| – Antal neutroner | 30 | ||||||
| – Antal av protoner | 26 | ||||||
| Atomradie | |||||||
| – Atomradie | 2.04 Å | ||||||
| – Kovalent radie | 1.24 Å | ||||||
| Joniseringsenergi
(kJmol-)1) |
1:a | 2:a | 3:a | 4:a | 5:a | 6:a | 7:a |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
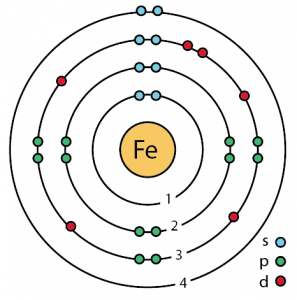
Järnets atomstruktur (Bohrmodellen)
Vad är de vanligaste användningsområdena för järn
- Järn används vid tillverkningen av olika typer av stål genom att legeras med andra grundämnen som kol, nickel, krom och volfram för att tillverka skärutrustning, cykelkedjor, gevärslöp, transmissionstorn, brobalkar och armerad betong.
- Ett rostfritt stål som innehåller en hög andel järn tillsammans med andra metaller har en enorm styrka och bättre funktion som är användbart vid tillverkning av kirurgiska instrument, gem, bestick, kullager och smycken .
- En annan form av Fe som kallas smidesjärn som erhålls genom smältning används för att tillverka snickarverktyg, lyftkrokar, kedjor, staket och grindar .
- Järnfyllningar kan användas i vetenskapliga experiment om elektromagnetism för att bedöma magneters styrka samt i kraftmetallurgi, konstverk, fyrverkerier och sandblästring .
- Fe fungerar som en effektiv katalysator i vissa industriella kemiska processer, t.ex. Haber-processen och Fischer-Tropsch .

Järnstång
Har grundämnet några toxiska effekter
Oavsiktligt intag av Fe har förknippats med kräkningar, diarré och andra gastrointestinala problem, en vanlig typ av metallförgiftning. Långvarig ackumulering i kroppen kan leda till andningsproblem och hjärtsjukdomar . Inandning av metalldamm eller rök kan orsaka en allvarlig lungreaktion .
Interessanta fakta
- Meteoriter tros ha ett högt järninnehåll .
- Järn användes som en magnetisk metall av forntida navigatörer i form av lodstenar för att tillverka kompasser .
- I en genomsnittlig människokropp finns det 4 gram Fe, som är förknippat med hemoglobin, som i sin tur hjälper till att föra syre till lungorna .
-

Järnpulver
Järnmetallpris
Kostnaden för rent järn kan variera mellan 0,24 och 0,30 dollar per pund.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Lämna ett svar