Molekylära dipolmoment
I molekyler som innehåller mer än en polär bindning är det molekylära dipolmomentet bara vektorkombinationen av vad som kan betraktas som individuella ”bindningsdipolmoment”. Matematiskt sett är dipolmoment vektorer; de har både storlek och riktning. En molekyls dipolmoment är därför vektorsumman av dipolmomenten hos de enskilda bindningarna i molekylen. Om de enskilda bindningarnas dipolmoment upphäver varandra finns det inget nettodipolmoment. Detta är fallet för CO2, en linjär molekyl (figur \(\PageIndex{1a}\)). Varje C-O-bindning i koldioxid är polär, men experiment visar att koldioxidmolekylen inte har något dipolmoment. Eftersom de två dipolerna för C-O-bindningar i koldioxid är lika stora och orienterade i 180° till varandra, upphävs de. Som ett resultat av detta har CO2-molekylen inget nettodipolmoment trots att den har en betydande laddningsskillnad. H2O-molekylen är däremot inte linjär (figur \(\PageIndex{1b}\)); den är böjd i det tredimensionella rummet, så dipolmomenten upphäver inte varandra. En molekyl som H2O har alltså ett nettodipolmoment. Vi förväntar oss att koncentrationen av negativ laddning finns på syret, den mer elektronegativa atomen, och positiv laddning på de två vätgaserna. Denna laddningspolarisering gör det möjligt för H2O att vätebindas till andra polariserade eller laddade arter, inklusive andra vattenmolekyler.
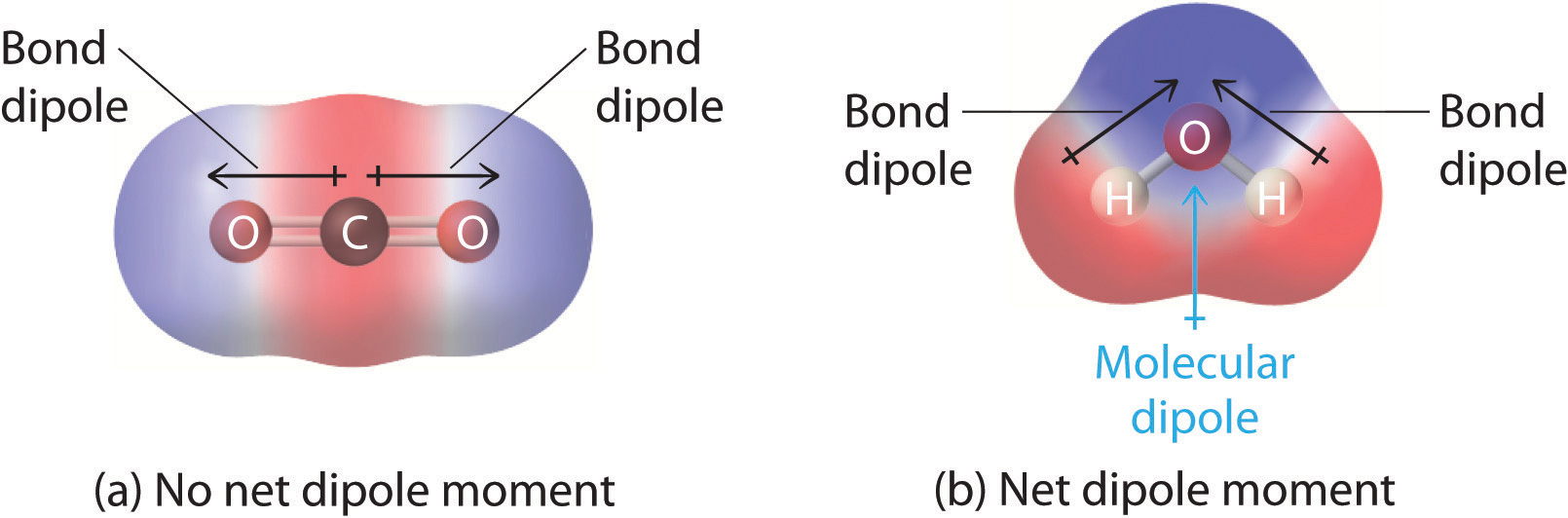
Figur \(\PageIndex{1}\): Hur enskilda bindningsdipolmoment adderas till varandra för att ge ett övergripande molekylärt dipolmoment för två treatomiga molekyler med olika strukturer. (a) I CO2 är C-O-bindningsdipolerna lika stora men orienterade i motsatt riktning (180°). Deras vektorsumma är noll, så CO2 har därför ingen nettodipol. (b) I H2O är O-H-bindningsdipolerna också lika stora, men de är orienterade i 104,5° till varandra. Därför är vektorsumman inte noll och H2O har ett nettodipolmoment.
Nedan följer en förenklad ekvation för ett enkelt separerat tvåladdningssystem som förekommer i diatomära molekyler eller när man betraktar en bindningsdipol inom en molekyl.
\
Denna bindningsdipol, µ (grekisk mu) tolkas som dipolen från en laddningsseparation över ett avstånd \(r\) mellan de partiella laddningarna \(Q^+\) och \(Q^-\) (eller de vanligare termerna \(δ^+\) – \(δ^-\)); dipolens orientering är längs bindningens axel. Enheterna för dipolmoment är vanligtvis debyer (D) där en deby motsvarar 3,336 x 1030 coulombmeter (C – m) i SI-enheter. Betrakta ett enkelt system med en enda elektron och proton som är separerade med ett fast avstånd. Enhetsladdningen på en elektron är 1,60 x 1019 C och proton & elektronen är 100 pm från varandra (ungefär längden på en typisk kovalent bindning), dipolmomentet beräknas som:
\ &= (1,60 \times 10^{-19}\, C)(1,00 \times 10^{-10} \,m) \nonumber \\\ &= 1,60 \times 10^{-29} \,C \cdot m \label{2} \end{align}\]
\ &= 4.80\; D \label{3} \end{align}\]
\(4,80\; D\) är ett viktigt referensvärde och representerar en ren laddning av +1 och -1 separerade med 100 pm. Om laddningsseparationen ökas ökar dock dipolmomentet (linjärt):
- Om protonerna och elektronerna separeras med 120 pm:
\
- Om protonerna och elektronerna var separerade med 150 pm:
\
- Om protonerna och elektronerna var separerade med 200 pm:
\
Exempel \(\PageIndex{1}\): Vatten
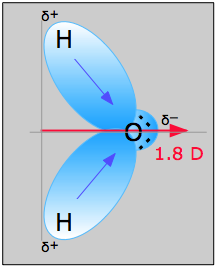
Vattenmolekylen i figur \(\PageIndex{1}\) kan användas för att bestämma dipolmomentets riktning och storlek. Utifrån elektronegativiteten hos syre och väte är skillnaden 1,2e för var och en av väte-oxygenbindningarna. Eftersom syre är den mer elektronegativa atomen utövar den en större dragningskraft på de delade elektronerna; den har också två ensamma elektronpar. Av detta kan man dra slutsatsen att dipolmomentet pekar från mellan de två väteatomerna mot syreatomen. Med hjälp av ekvationen ovan beräknas dipolmomentet till 1,85 D genom att multiplicera avståndet mellan syre- och väteatomerna med laddningsskillnaden mellan dem och sedan hitta de komponenter av var och en av dem som pekar i riktning mot nettodipolmomentet (molekylens vinkel är 104).5˚).
Bindningsmomentet för O-H-bindningen =1,5 D, så nettodipolmomentet är
\
Lämna ett svar