Bindning i acetylen
För det sista gäller konceptet med hybridorbitaler väl för trippelbundna grupper, som alkyner och nitriler. Tänk till exempel på strukturen hos etyn (vanligt namn acetylen), det enklaste alkynet.
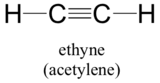
Denna molekyl är linjär: alla fyra atomer ligger i en rak linje. Kol-kol trippelbindningen är endast 1,20Å lång. I hybridorbitalbilden av acetylen är båda kolvätena sp-hybridiserade. I ett sp-hybridiserat kol kombineras 2s orbitalet med 2px orbitalet för att bilda två sp hybridorbitaler som är orienterade i en vinkel på 180° i förhållande till varandra (t.ex. längs x-axeln). 2py- och 2pz-orbitalerna förblir ohybriderade och är orienterade vinkelrätt längs y- respektive z-axeln.


C-C-sigmabindningen bildas alltså av överlappningen av en sp-orbital från var och en av kolvätena, medan de två C-H-sigmabindningarna bildas av överlappningen av den andra sp-orbitalen på varje kol med en 1s-orbital på ett väte. Varje kolatom har fortfarande två halvfyllda 2py- och 2pz-orbitaler, som är vinkelräta både mot varandra och mot den linje som bildas av sigmabindningarna. Dessa två vinkelräta par av p-orbitaler bildar två pi-bindningar mellan kolatomerna, vilket resulterar i en trippelbindning totalt sett (en sigma-bindning plus två pi-bindningar).

Begreppet hybridorbital förklarar på ett bra sätt en annan experimentell observation: Enkelbindningar intill dubbel- och trippelbindningar är successivt kortare och starkare än ”normala” enkelbindningar, till exempel den i en enkel alkan. Kol-kol-bindningen i etan (struktur A nedan) är resultatet av att två sp3-orbitaler överlappar varandra.

I alken B är dock kol-kol-singelbindningen resultatet av överlappning mellan en sp2-orbital och en sp3-orbital, medan kol-kol-singelbindningen i alkan C är resultatet av överlappning mellan en sp-orbital och en sp3-orbital. Dessa är alla enkelbindningar, men bindningen i molekyl C är kortare och starkare än bindningen i B, som i sin tur är kortare och starkare än bindningen i A.
Förklaringen här är relativt okomplicerad. En sp-orbital består av en s-orbital och en p-orbital och har således 50 % s-karaktär och 50 % p-karaktär. sp2-orbitaler har som jämförelse 33 % s-karaktär och 67 % p-karaktär, medan sp3-orbitaler har 25 % s-karaktär och 75 % p-karaktär. På grund av sin sfäriska form är 2s orbitaler mindre och håller elektronerna närmare och ”tätare” vid kärnan, jämfört med 2p orbitaler. Följaktligen är bindningar med sp + sp3-överlappning (som i alken C) kortare och starkare än bindningar med sp2 + sp3-överlappning (som i alken B). Bindningar som involverar sp3-sp3överlappning (som i alkan A) är de längsta och svagaste i gruppen, på grund av hybridernas 75 % ”p”-karaktär.
Lämna ett svar