Na reacção com o amoníaco, porque é que a água é o ácido?
Esta é uma grande reacção química geral com importantes implicações na química orgânica. Outra questão semelhante é, porque é que a água é uma base quando reagiu com um “ácido”? A resposta a ambas as perguntas é: é tudo relativo! Aqui no StudyOrgo, frequentemente recebemos perguntas como esta sobre tópicos de química orgânica que normalmente são rapidamente abordados, mal descritos ou esperados que você conhece de cursos anteriores. Estes conceitos são realmente importantes para entender os tópicos mais complexos que estão por vir. Com uma associação ao StudyOrgo, você receberá ainda mais dicas e truques sobre tópicos de Química Orgânica e mecanismos detalhados com explicações. O blog de hoje é uma prévia dos tópicos detalhados e materiais disponíveis. Confira uma associação ao StudyOrgo.com e inscreva-se hoje!
Remmbre que em termos de ácidos e bases, existem duas definições; a definição Bronsted e a definição Lewis. Os ácidos de Bronsted são definidos como doadores de prótons, enquanto os ácidos de Lewis são definidos como aceitadores de elétrons. Ambos são ácidos, mas o que nós pensamos diferentemente é se prótons ou elétrons estão envolvidos. Em uma solução aquosa, química geral ou bioquímica, pensamos principalmente na definição de Bronsted porque a dissociação dos prótons dos ácidos muda a concentração da solução de H+, que interpretamos como uma mudança no pH e a “acidez” da solução. Medimos a dissociação dos prótons dos ácidos, ou a aceitação dos prótons por bases, com um valor numérico que é o pKa. Quanto maior o pKa, mais fraco o ácido e mais forte a base. Quanto mais baixo o pKa, mais forte o ácido e mais fraca a base. Um truque fácil para pensar em pKa é, colocar a versão protonada da molécula à esquerda e pensar nela como um doador de protões. A pKa diz-lhe como esta doação será fácil, quanto menor o número mais fácil a doação de protões.
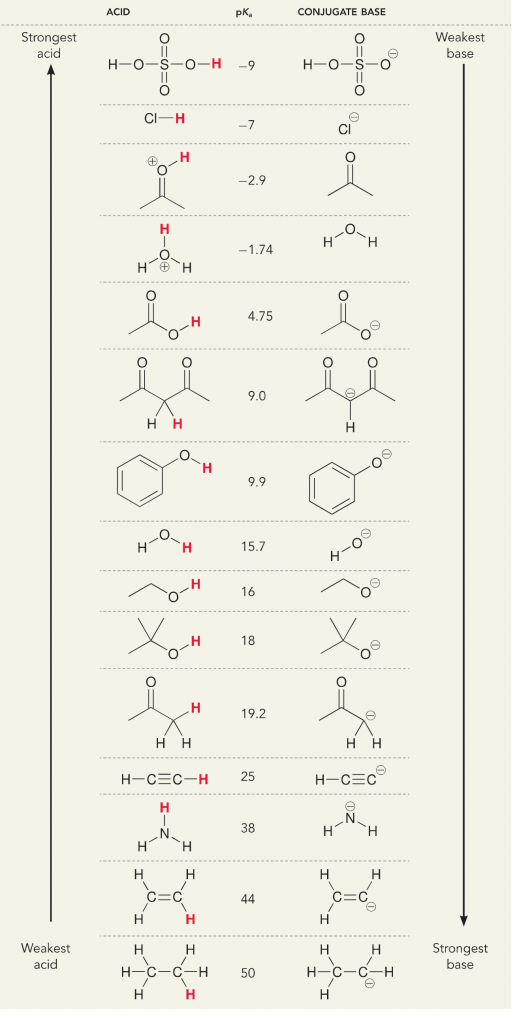
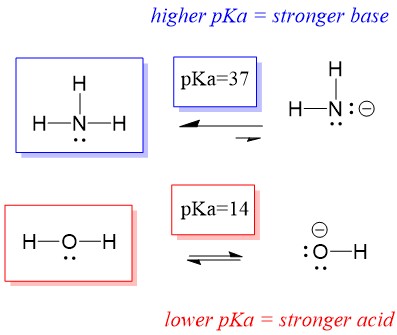
Vejamos a reacção do amoníaco e da água; a pKa para água é definida como 14. A pKa para amônia é ~37.
>
Por isso, como a pKa da água é menor que a amônia, é um ácido mais forte a amônia e doará prótons à base de amônia. Esta reacção leva a água a tornar-se a base conjugada OH- e o amoníaco a tornar-se o ácido conjugado NH4+. Curiosamente, é por isso que a amônia é um agente cáustico, ela produz hidróxido que reage com manchas e microorganismos para efetivamente limpar e higienizar itens domésticos.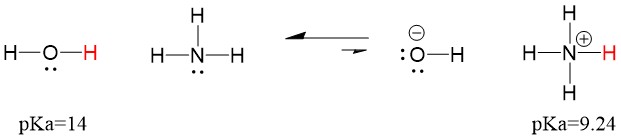
Isto é importante como um conceito de química orgânica, porque a força dos ácidos e bases em termos de elétrons, ou a definição de Lewis, é exatamente como pensamos sobre mecanismos de quebra de ligação e formação de ligação; o fluxo de elétrons. A força dos ácidos de Lewis e do ácido conjugado pode ajudar a identificar em que direção uma reação irá prosseguir. Podemos ver que a reação de água e amônia é desfavorável, mas o suficiente da reação ocorre na realidade para reduzir significativamente o pH da água (pH~11 com amônia).
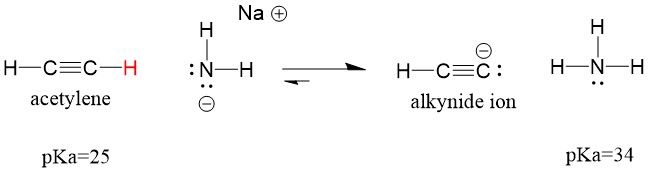
Vejamos um acetileno reagindo com uma base para gerar um íon alcynide, um nucleófilo útil para a formação de ligação C-C. Se tentarmos reagir com hidróxido de sódio com alquino, o íon alcynide NÃO se formará. Isto porque o produto ácido conjugado da reação é água, que tem uma pKa de 15, é mais forte que o acetileno ácido original (pKa = 25). As reações SEMPRE favorecem a formação do ácido mais fraco, ou neste caso, do lado reativo.
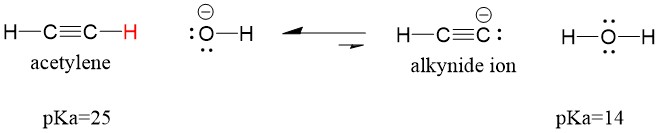
Se mudarmos nossa base para amida de sódio, que é uma base muito mais forte, o íon alcynide IRÁ se formar. Isto porque o produto ácido conjugado da reação é amônia, que tem uma pKa de 38, e é um ácido conjugado WEAKER do que o acetileno ácido original (pKa = 25). Neste caso, a reação favorece o lado do produto!

Deixe uma resposta