Dipole – dipole forces
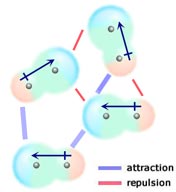
Se duas moléculas neutras, cada uma com um momento dipolo permanente, se juntarem de tal forma que as suas extremidades com carga oposta se alinhem, elas serão atraídas uma pela outra. Num líquido ou sólido, estes alinhamentos são favorecidos em relação àqueles em que as extremidades das moléculas carregadas da mesma forma estão próximas uma da outra e, portanto, repelem-se mutuamente.
Uma razão pela qual o CH3F tem um ponto de ebulição superior (-84 °C) ao CF4 (-128 °C) é que o CF3H tem um momento dipolo permanente, enquanto que o CF4 não tem. Para entender isso, você precisa saber que o CF4 tem forma tetraédrica e o CH3F é aproximadamente tetraédrico (não há uma grande diferença nas formas dessas moléculas). As ligações carbono – flúor em ambas as moléculas são polares (o flúor é muito mais electronegativo do que o carbono), contudo a presença de quatro ligações C-F na molécula tetraédrica CF4 torna a molécula globalmente não polar. O momento dipolo da única ligação C-F em CH3F não é anulado pelos dipolos de ligação C-H (que são muito pequenos), portanto o CH3F tem um momento dipolo permanente.
Um tipo de força intermolecular que pode surgir em circunstâncias particulares e é geralmente classificada como uma interação dipolo/dipolo, embora tenha algum caráter de ligação covalente é a ligação de hidrogênio.
Deixe uma resposta