- Introdução
- Experimental
- Materiais
- Síntese de Compostos de Intercalação
- Caracterização
- Resultados e Discussão
- Caracterização do DRX
- FTIR Spectra
- Modelo Estrutural dos Compostos de Intercalação Kaol/alquilamina
- Análise térmica
- Decomposition Reaction Kinetics
- Conclusões
- Author Contributions
- Conflict of Interest Statement
- Acknowledgments
Introdução
Desenho e fabricação de nanocompósitos argilosos/poliméricos têm atraído grande interesse das comunidades científica e de engenharia (Cheng et al., 2017). Uma grande variedade de nanocompósitos argilosos/poliméricos tem sido desenvolvida e está sendo usada em ampla aplicação (Gogoi e Raidongia, 2017). A pré-intercalação de argilas seguida da incorporação de polímeros na camada mineral de argila é uma abordagem amplamente adotada para a preparação de nanocompósitos argilosos/poliméricos (Li et al., 2009; Zare et al., 2017). Enquanto intercalados dentro de camadas de argila inorgânica, cadeias de polímeros orgânicos reduzem naturalmente sua mobilidade estrutural e alguns deles assumem uma conformação altamente organizada dentro da estrutura em camadas.
Na natureza, a caulinita (Kaol) é um tipo de mineral argiloso com uma estrutura em camadas de silicato de alumínio dioctaédrico 1:1 (Brindley e Robinson, 1945). As camadas em Kaol são mantidas juntas por ligações de hidrogênio, interações dipolo/dipolo e forças van der Waals (Brindley et al., 1967). Entretanto, apenas um número limitado de espécies orgânicas altamente polares incluindo uréia (Makó et al., 2009), dimetil sulfóxido (Costanzo e Giesse, 1986), formamide (Frost et al., 2000a), hidrazina (Cruz e Franco, 2000), e acetato de potássio (Frost et al., 2000b) foram intercalados com sucesso na galeria de Kaol. A intercalação de pequenas moléculas nas camadas de Kaol causa um aumento no espaçamento basal, e pode ser usada como um passo preliminar de expansão para a posterior inserção de espécies de grande porte, não reativas, pelo deslocamento das pequenas moléculas pré-intercaladas (Cheng et al., 2015). Por exemplo, com base nos relatórios anteriores, um composto de intercalação Kaol/metanol pode ser um intermediário eficaz para a reação de intercalação posterior com etilenoglicol (Hirsemann et al., 2011), hexilamina (Matusik et al., 2012), n-alquilaminas (Gardolinski e Lagaly, 2005) e sais de amônio quaternário (Cheng et al., 2016). Além disso, a maioria das moléculas convidadas são difíceis de serem inseridas no espaço entre camadas, uma das razões é a forte ligação de hidrogênio, outra é que não há íons permutáveis na estrutura Kaol.
Embora os nanocompósitos argilosos/poliméricos tenham sido bem desenvolvidos nos últimos anos, a síntese de novos nanocompósitos argilosos/orgânicos para aplicação potencial ainda apresenta um grande desafio (Kotal e Bhowmick, 2015). A fim de resolver este problema, é realmente urgente descobrir o processo de intercalação de caulinite à escala nanométrica e fazer uma investigação exaustiva ao mecanismo de decomposição com tecnologia moderna e ferramentas analíticas. A análise térmica e o cálculo cinético dos compostos de intercalação argila/polímero podem ajudar a caracterizar os processos de decomposição e fornecer uma base científica para o controlo das reacções de intercalação (Zhang et al., 2015). Os parâmetros cinéticos do processo cinético da reação de decomposição, tais como a energia de ativação, pré-exponencial, ordens de reação e constante de taxa foram avaliados com os dados dos termogramas de argila/polímero. Neste estudo, foi investigada a intercalação do Kaol com várias alquilaminas. Adicionalmente, o processo de intercalação e o mecanismo de decomposição foi sistematicamente investigado.
Experimental
Materiais
Kaolin utilizado neste estudo foi explorado de Zhangjiakou, China. A composição mineral principal é uma caulinite bem ordenada (95% em massa). Foi moído para passar uma peneira de 325 malhas (partículas que medem < 44 μm) antes da intercalação. Alquilamina hexilamina (HA, 99%), dodecilamina (DA, Quimicamente Pura) e octadecylamina (OA, Quimicamente Pura) foram adquiridas da Nanjing Shuguang Chemical Company, China. Dimetil sulfóxido (DMSO, Reagente Analítico), metanol (MeOH, Reagente Analítico) e tolueno (99%) foram recebidos da Xilong Chemical Company, China, e usados como recebidos sem purificação adicional. A fórmula química e a fórmula estrutural de HA, DA, e OA são mostradas na Tabela 1.

Tabela 1. Fórmula química e estrutural de HA, DA e OA.
Síntese de Compostos de Intercalação
Primeiro, o composto de intercalação Kaol/DMSO foi preparado dispersando 20,0 g de Kaol em uma mistura de 36,0 g de DMSO e 4,0 g de água. A mistura foi agitada em banho-maria durante 2 h a 95°C e, em seguida, a suspensão foi separada por centrifugação com etanol. Em segundo lugar, o composto de intercalação Kaol/DMSO foi utilizado como um precursor para posterior reação com MeOH. O MeOH foi adicionado ao Kaol pré-intercalado e a mistura de reação foi agitada por 10 dias, sendo o MeOH substituído a cada dia por uma mesma quantidade de MeOH fresco. O precipitado na mistura foi separado por centrifugação e seco em forno a 60°C durante 12 h para obter compostos de intercalação Kaol/MeOH. Finalmente, 2 g de composto de intercalação Kaol/MeOH foi misturado com 30,0 mL HA, DA ou soluções de metanol OA (1 mol/L) por agitação à temperatura ambiente, respectivamente. As dispersões foram centrifugadas após reação por 24 h. Os sedimentos foram lavados três vezes com tolueno para remover o excesso de HA, DA ou OA. As amostras foram secas à temperatura ambiente durante 12 h e moídas em pó com argamassa de ágata (Komori et al., 1999). Os compostos resultantes são rotulados como Kaolpi/HA (pi como pré-intercalado), Kaolpi/DA, e Kaolpi/OA.
Caracterização
Os padrões de DRX foram registrados em um difratômetro de raios X Rigaku D/max 2500PC com Cu Kα (λ = 1,54178 Å), operando com radiação de 40 kV e 150 mA. As amostras orientadas aleatoriamente foram escaneadas no intervalo 2θ entre 1 e 20° a uma velocidade de 2° min-1. Um espectrofotómetro Thermo Fisher Nicolet 6700 foi utilizado para registar os espectros FTIR dentro do intervalo de 4.000~400 cm-1. As análises TG-DSC foram realizadas com um analisador térmico simultâneo Mettler-Toledo TG-DSC I/1600 HT sob atmosfera de nitrogênio. Vinte miligramas de amostra foram colocados em um cadinho de alumina e aquecidos de 30 a 1.100°C com uma série de taxas de aquecimento a 4, 6, 8, 10°C min-1,
Resultados e Discussão
Caracterização do DRX
Os padrões do DRX do Kaol puro e seus compostos de intercalação são mostrados na Figura 1. O padrão do Kaol prístino exibe uma estrutura em camadas bem ordenada com um espaçamento basal de 0,71 nm. Este valor combina bem com o padrão de referência do ICDD 14-0164 . Ao ser tratado com DMSO, um novo pico de reflexão basal apareceu a 1,14 nm, indicando que o DMSO foi inserido com sucesso nos interlayers Kaol. Após o composto de intercalação Kaol/DMSO ter sido tratado com MeOH, a característica de reflexão de 1,14 nm (001) do composto de intercalação Kaol/DMSO foi deslocada para 0,86 nm. Foi relatado por Matusik et al. (2012) que o composto Kaol/DMSO/MeOH foi seco a 110°C, a reflexão com d = 1,12 nm desapareceu e foi observada uma reflexão ampla com o máximo a 0,95 nm. Baseado na fórmula química Al2Si2O5(OH)3.20(OCH3)0.80 do composto de intercalação Kaol/DMSO que foi calculado de acordo com a base da análise CHNS, mostrou que cerca de 1/3 dos grupos OH de superfície interna foram substituídos por grupos metoxi, e esta observação também sugere a formação de um composto de intercalação Kaol/MeOH (Tunney e Detellier, 1996; Cheng et al., 2015). Os padrões XRD também mostram que os compostos Kaol/MeOH intercalados com HA, DA e OA expandem a estrutura ao longo do eixo c, levando a uma grande distância entre camadas de 2,86, 4,08 e 5,66 nm, respectivamente. Os comprimentos das cadeias moleculares HA, DA e OA são de 1,56, 2,51 e 3,65 nm, respectivamente (McNulty et al., 2011, 2014). Em geral, a distância entre camadas dos compostos de intercalação Kaol/alquilamina aumentou com o comprimento da cadeia alquílica das alquilaminas, mas a molécula de alquilamina não é uma única camada ou estrutura de bilayer que é perpendicular à superfície do Kaol.
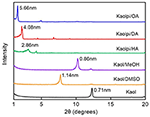
Figura 1. Padrões XRD de Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA, e Kaolpi/OA.
FTIR Spectra
FTIR espectroscopia tem sido amplamente utilizada na caracterização de compostos de intercalação (Ledoux e White, 1964; Frost et al., 2000c; Cheng et al., 2012). Os espectros FTIR do Kaol original, Kaolpi/HA, Kaolpi/DA e compostos de intercalação Kaolpi/OA são mostrados na Figura 2. As bandas características em 432, 470 e 541 cm-1 (Figura 2B) pertencem ao modo de deformação de Si-O, Si-O-Si, e Al-O-Si. As outras bandas a 1.009, 1.031 e 1.114 cm-1 (Figura 2C) são atribuídas às vibrações de alongamento do Si-O-Si na camada de Kaol. Comparando os espectros do Kaol e seus compostos de intercalação, a posição das bandas não tem variação aparente, o que indica que estas bandas de vibrações de estiramento não são afetadas pelas moléculas intercaladas.
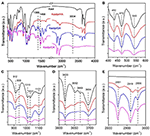
Figura 2. Espectros infravermelhos de Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
As bandas a 912 e 938 cm-1 (Figura 2C) pertencem à deformação OH dos grupos hidroxila internos e grupos hidroxila de superfície interna. Existem quatro bandas óbvias de hidroxila a 3,694, 3,669, 3,652 e 3,620 cm-1 (Figura 2D) no espectro do Kaol original, as bandas a 3,694, 3,669 e 3,652 cm-1 são causadas pelos grupos hidroxila de superfície interna, enquanto a banda a 3,620 cm-1 resulta dos grupos hidroxila internos (Farmer, 1964; Ledoux e White, 1964; Giese e Datta, 1973). Após a intercalação das moléculas de alquilamina, algumas bandas foram enfraquecidas devido à alteração das interacções com os átomos vizinhos. A mudança para 3.697 cm-1 e a diminuição da intensidade da banda para 3.694 cm-1 indica que numerosos grupos hidroxila em Kaol participaram e formaram ligações de hidrogênio com os grupos aminas nas moléculas de alquilamina (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
A presença de moléculas de alquilamina entre camadas foi detectada no espectro FTIR pelos novos picos, que são mostrados nas Figuras 2A,E. Para os compostos de intercalação, alguns picos característicos óbvios como a banda de 1.388 e 1.468 cm-1 pertencem ao modo de flexão C-H de -CH3 e -CH2, respectivamente. Foi observada uma nova banda de vibração a 3.334 cm-1 que se deve ao modo de estiramento da vibração de estiramento N-H (Griffiths e De Haseth, 2007; Zhang et al., 2018). A nova banda de vibração a 2.956 cm-1 foi observada e normalmente atribuída à banda de estiramento assimétrico C-H dos grupos metilo terminais (Cheng et al., 2016). As duas bandas de vibração a 2.919 e 2.851 cm-1 são normalmente atribuídas às vibrações de estiramento simétrico e assimétrico do -(CH2)n- (Venkataraman e Vasudevan, 2001). A intensidade das bandas aumenta gradualmente, o que significa que mais átomos de carbono alquilamina foram inseridos nas camadas intermédias de Kaol. Além disso, a volatilidade das alquilaminas diminuirá com o aumento da cadeia de carbono, de modo que a estabilidade dos compostos de intercalação Kaol correspondentes aumentará gradualmente com maior massa molecular de alquilaminas (Wang et al., 2010).
Modelo Estrutural dos Compostos de Intercalação Kaol/alquilamina
O arranjo das moléculas intercaladas é a base para a análise experimental da estrutura do composto de intercalação Kaol/alquilamina. De acordo com Lagaly (1981), os modelos estruturais dos compostos de intercalação montmorilonite-quaternário de sal de amónio podem ser divididos em três categorias: (a) monocamadas: íons alquilamínicos de cadeia curta; (b) bicamadas: íons de amônio quaternário de cadeia longa; (c) tricamadas: cadeias alquilamínicas dobradas em minerais argilosos altamente carregados. Beneke e Lagaly (1982) propuseram ainda uma estrutura diferente das moléculas de alquilamina intercaladas com base no DRX, que se resumem como se segue: a) As cadeias alquílicas no espaço entre camadas são inclinadas para o (001) plano cristalino; b) As cadeias alquílicas são dispostas em camadas de bílis. Brindley e Moll (1965) descreveram que as moléculas intercaladas são inclinadas para as folhas de silicato em uma única camada, enquanto o ângulo é de cerca de 65° a (001) plano cristalino. Se as moléculas em interação estão uniformemente ligadas a todas as superfícies de silicato pelos grupos hidroxil ativos, sugere-se uma organização “ponta a ponta” em pares com algum deslocamento longitudinal. O ângulo de inclinação está de acordo com a possível forma de empacotamento próximo entre as superfícies de silicato de oxigênio e os grupos hidroxila terminais e o grau de empacotamento próximo das moléculas de cadeia entre si.
As moléculas alquílicas são difíceis de intercalar diretamente as camadas originais de Kaol já que faltam íons intercambiáveis no espaço entre camadas de Kaol. Precursores válidos são essenciais quando as moléculas alquilamínicas se inserem na camada intermédia de Kaol. Foi relatado que a cadeia de cloreto de alquil trimetilamónio forma um bileto inclinado na camada intermédia de Kaol e o ângulo de inclinação é de ~36° após cálculo (Kuroda et al., 2011). Yuan et al. (2013) apontaram que o arranjo estrutural das moléculas de sal de amónio quaternário na camada intermédia de Kaol e o ângulo de inclinação é de ~38,4°. Gardolinski e Lagaly (2005) propuseram que as cadeias alquílicas nas camadas intermédias sejam totalmente esticadas e orientadas perpendicularmente à superfície do Kaol pelo bico. Portanto, analisando o comprimento das cadeias de moléculas HA, DA e OA, pode-se concluir que o espaçamento basal após a intercalação não é suficiente para permitir que a cadeia alquílica entre pela forma vertical e por camadas de bico. Pode ser visto, analisando melhor os resultados do XRD, que as cadeias alquílicas de HA, DA e OA são inclinadas para a superfície Kaol no bileer e o ângulo inclinado das cadeias alquílicas é de cerca de 39,9, 39,9, 41,1°, respectivamente. Além disso, devido à ligação hidroxila entre os grupos hidroxila da superfície interna em Kaol e aminas em moléculas de alquilamina, o modelo estrutural mais possível para os compostos de intercalação Kaol/alquilamina é mostrado na Figura 3.
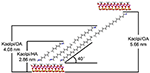
Figura 3. O modelo estrutural mais possível para os compostos de intercalação caulinite/alquilamina.
Análise térmica
Os resultados da análise TG-DSC do Kaol e seus compostos de intercalação são mostrados na Figura 4. A principal perda de massa de Kaol é aquela entre 400 e 600°C com a taxa máxima de perda a 525°C atribuída à perda de água por causa da desidroxilação da malha cristalina, resultando na formação de meta-kaolinita (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Esta perda corresponde a cerca de 12,7% da massa total, o que está extremamente próximo da referência teórica (13,9%). Comparando as curvas TG-DSC do Kaol original, duas etapas principais de perda de massa são observadas no Kaolpi/HA, Kaolpi/DA, e compostos de intercalação Kaolpi/OA. O primeiro ocorreu entre 150 e 350°C, devido à decomposição das moléculas de alquilamina intercaladas (Yuan et al., 2013). A segunda ocorreu a cerca de 500°C, devido à desidroxilação do Kaol desintercalado. Para Kaolpi/OA, alguns OA foram intercalados no espaço entre camadas de silicato para formar uma intercalação estável, o que pode ser comprovado pelo padrão de DRX. Algumas moléculas estão enredadas umas dentro das outras devido à longa cadeia ou uma braçadeira nos nanos rolos que não podem ser totalmente removidas (Li et al., 2015; Liu et al., 2016). A 220°C, a perda de massa distinta é devida à decomposição do AO revestido ou não ligado, enquanto a perda de massa a 330°C é atribuída à decomposição do AO intercalado. O pico exotérmico a 996°C é resultado da recristalização do Kaol.
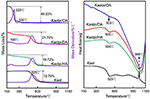
Figure 4. Curvas TG-DSC para Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Comparando as curvas TG-DSC do Kaol original e dos compostos de intercalação Kaol/alkylamine (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA), pode-se observar: a) Tem diferentes etapas de perda de massa, assim como uma diferença significativa nas perdas de massa entre Kaolpi/OA e os outros dois compostos de intercalação (Kaolpi/HA, Kaolpi/DA). A perda de massa para a decomposição de Kaolpi/HA e Kaolpi/DA foi de cerca de 20%, mas a quantidade das duas perdas de massa para Kaolpi/OA é de cerca de 50%. Isto pode ser devido a uma quantidade maior de OA foi intercalada no espaço entre camadas de silicato do que aquele HA e DA (Wang et al., 2017). (b) A temperatura de desidroxilação dos compostos de intercalação foi inferior à do Kaol original em cerca de 20°C. Isto porque as moléculas de intercalação expandiram o espaçamento entre camadas, enfraquecendo as ligações de hidrogênio entre as camadas de Kaol, provocando uma desidroxilação mais fácil a partir da superfície de Kaol. Portanto, a cristalinidade do Kaol diminuiu drasticamente após a intercalação, o que pode ser confirmado pelo XRD e IR (abaixo de 800 cm-1). Este resultado é consistente com a conclusão de alguns outros relatórios de que a temperatura de desidroxilação foi determinada pela cristalinidade do Kaol (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Decomposition Reaction Kinetics
As cinéticas de degradação do composto de intercalação Kaol/alquilamina foram investigadas por técnicas de termogravimetria. Os parâmetros cinéticos (energia de ativação E e fator A pré-exponencial) do processo de degradação foram calculados sobre os métodos básicos de KAS e Ozawa (Kissinger, 1957; Säkvára and Säesták, 1975). O mecanismo de degradação térmica do composto de intercalação Kaol/alquilamina foi estudado com o método integral de Satava (Xie et al., 2001; Gao et al., 2005; Zhang et al, 2015).
Segundo a teoria da reação, a fórmula cinética de decomposição não isotérmica é geralmente expressa da seguinte forma:
onde α é a extensão da taxa de conversão de B(s) no tempo t, f (α) é a função do mecanismo de reação, e k é a taxa de reação constante. k obedece à seguinte equação:
Se a temperatura da amostra for controlada a uma taxa de aquecimento constante (β = dT/dt), a taxa de reacção pode ser definida da seguinte forma:
Após a separação da variável, o rearranjo com funções integrais ou diferenciais da Equação (4), Equação de KAS (5) e Equação de Ozawa (6) pode ser calculado da seguinte forma:
Where G(α) representa a função integral da conversão. Devido à aproximação integral, foram utilizados métodos iterativos para calcular E, a fim de evitar certos desvios. As funções dos métodos iterativos são as seguintes:
Set x = E/RT, a definição de h(x) e H(x) são:
As iterações são as seguintes três etapas:
(a) Definir h(x) = 1 ou H(x) = 1, calcular E0 pelo método dos mínimos quadrados de acordo com a inclinação da relação linear lnβ/T2 e lnβ a 1/T.
(c) Substituir E0 por E1, repetir o passo (b) até Ei-Ei-1 < 0. 1 kJ mol-1. Ei é o valor exato da energia de ativação da reação de decomposição.
Os valores E dos compostos de intercalação Kaol/alquilamina foram calculados por KAS, Ozawa, e métodos iterativos (Tabela 2). Os resultados calculados pelo método KAS foram mais próximos dos resultados dos métodos iterativos, entretanto, os resultados do método iterativo de Ozawa apresentaram maior desvio para outros. Portanto, a média E dos métodos iterativos pode ser considerada como a energia de ativação da reação de decomposição, já que são uma melhora em relação aos métodos KAS e Ozawa. A média E de Kaolpi/HA, Kaolpi/DA e Kaolpi/OA é de 104,44, 130,80 e 154,59 kJ mol-1. Pode-se observar que o E médio entre os compostos Kaol/alkylamine são correlação positiva com o comprimento da cadeia alquílica. Uma das razões é que a volatilidade se enfraquece à medida que a cadeia alquílica cresce. Outra razão é que o Kaolpi/OA possui a melhor estrutura de intercalação bem ordenada, que é a mais difícil de desintercalar. E estes resultados podem ser confirmados pelos padrões XRD.
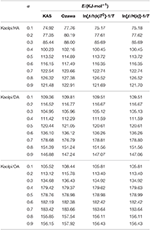
Tábua 2. E de compostos de intercalação Kaol/alquilamina com diferentes α calculados por KAS, Ozawa e métodos de iteração.
As funções e A do mecanismo de reação de decomposição foram calculadas pelos métodos Satava, que foram descritos a seguir:
Substituir α em cada função do mecanismo G(α) para obter o valor de lg, lg de encaixe linear, e 1/T que corresponde à taxa de aquecimento, a função que tem o maior encaixe pode ser determinada como a função do mecanismo mais provável. E os valores de E e A podem ser obtidos através da inclinação e interceptação de uma curva de ajuste linear.
Como mostrado na Tabela 3, cinco funções do mecanismo com bondade de ajuste acima de 90% são escolhidas com base na fórmula integral Satava. Comparando essas cinco funções, a função de mecanismo nº 9 G(α) = 2 com bondade de ajuste cerca de 97% pode ser considerada como a função de mecanismo mais provável, e as curvas de ajuste linear da função nº 9 foram mostradas na Figura 5. E e A também estão na faixa normal da cinética de decomposição. As funções do mecanismo de decomposição para os três compostos de intercalação Kaol/alquilamina são dadas na Tabela 4.

Tábua 3. Funções de mecanismo cinético selecionadas julgadas pelo método integral Satava.

Figura 5. Curvas de ajuste linear da função nº 9 julgadas pelo método integral Satava.

Tabela 4. Funções do mecanismo cinético dos compostos de intercalação Kaol/alquilamina.
Conclusões
Os possíveis modelos de estrutura e cinética de decomposição dos compostos de intercalação Kaol/alquilamina foram estudados usando XRD, FT-IR, e TG-DSC. A intercalação do composto Kaol/MeOH com HA, DA e OA expande o espaçamento entre camadas de Kaol ao longo do eixo c, resultando no aparecimento da reflexão dominante a 2,86, 4,08 e 5,66 nm, respectivamente. Além disso, o espaçamento basal após a intercalação não é suficiente para permitir que a cadeia alquídica entre pela forma vertical única e bileira. Concluiu-se que as cadeias alquídicas de HA, DA e OA são inclinadas para a superfície do Kaol no bileer e o ângulo de inclinação das cadeias alquídicas é de ~40°.
Baseado no KAS, Ozawa e métodos iterativos, foram calculados os resultados da energia de ativação E dos compostos de intercalação Kaol/alquilamina. A energia média de ativação E de Kaolpi/HA, Kaolpi/DA e Kaolpi/OA são 104,44, 130,80 e 154,59 kJ mol-1. A energia média de ativação E dos compostos Kaol/alquilamina tem uma correlação positiva com o comprimento da cadeia alquílica. A função do mecanismo otimizado do processo de decomposição Kaol/alquilamina foi determinada como uma difusão 3D com a função integral G(α) = 2. Esta pesquisa é vantajosa para entender melhor o mecanismo de decomposição de nanocompósitos argilosos/orgânicos, além de fornecer uma inspiração para sintetizar novos materiais baseados em argila.
Author Contributions
HC e QfL desenharam a experiência e revisaram o trabalho. YZ, QhL, e PX fizeram os experimentos e escreveram o artigo. YZ e QhL contribuíram igualmente para este trabalho.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Acknowledgments
Dr. Luyi Sun (Departamento de Engenharia Química e Biomolecular e Programa de Polímeros, Instituto de Ciência de Materiais, Universidade de Connecticut) é reconhecido por ter revisado o trabalho. Os autores agradecem o apoio financeiro fornecido pela National Natural Science Foundation of China (41602171), a Beijing Natural Science Foundation (8164062) e o Projeto Yue Qi Young Scholar, China University of Mining & Technology, Beijing.
Giese, R., and Datta, P. (1973). Orientação hidroxila em caulinita, dickite e nacrite. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., e De Haseth, J. A. (2007). Espectrometria de Infravermelho por Transformada de Fourier. Nova York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., e Guggenheim, S. (1985). Desidroxilação da caulinite. Am. Mineral. 70, 1-2.
Google Scholar
Deixe uma resposta