PAPELES ORIGINAIS
Detecção de antigénios de superfície da hepatite B usando soros agrupados. Uma análise custo-benefício
E. Fernández, L. Rodrigo1, S. García, S. Riestra1 e C. Blanco
>
Serviço de Bioquímica. Hospital de Cabueñes. Gijón. 1Serviço de Gastroenterologia. Hospital Central de Asturias. Oviedo. Espanha
Correspondência
ABSTRACT
Objectivos: examinar a viabilidade e realizar uma análise custo-benefício de uma estratégia de agrupamento de 5 amostras utilizando um imunoensaio enzimático (EIA) para o rastreio do antigénio de superfície da hepatite B (HBsAg).
Material e métodos: para avaliar a sensibilidade e especificidade do método de agrupamento, cada um dos 40 soros positivos (do fraco ao intenso HBsAg-positivo) e 250 soros negativos foram testados em um agrupamento com 4 soros HBsAg-negativos. O limite de detecção de HBsAg/ad e HBsAg/ay foi avaliado usando soros de um painel de subtipos purificados. Um estudo em condições reais foi realizado utilizando piscinas de 340 mulheres grávidas.
Resultados: a sensibilidade e especificidade desta técnica foram de 100%. O coeficiente de correlação entre as proporções amostra/cutoff de 40 amostras estudadas em condições simples e em conjunto foi de 0,792 (p < 0,005). O método pooling tem níveis de detecção inferiores para HBsAg/ad e HBsAg/ay a 0,20 ng/mL e 0,12 ng/mL, e o método single a 0,34 ng/mL e 0,29 ng/mL, respectivamente. O método de pooling não perde sensibilidade para valores até 100 IU/L de anti-HBs nos quatro soros misturados com um soro positivo. A análise custo-benefício mostrou que o método de pooling poderia economizar de 30% a 75% do custo da determinação do HBsAg, conforme as soroprevalências fossem de 10% ou 1%, respectivamente.
Conclusões: o pool de HBsAg EIA não resultou pior do que o teste de AIE único, e foi uma estratégia econômica e válida em áreas com uma prevalência alta, média ou baixa.
Palavras-chave: Antígeno de superfície da Hepatite B. Soros de agrupamento. Análise custo-benefício.
Rodrigo L, Fernández E, García S, Riestra S, Blanco C. Detecção do antígeno de superfície da hepatite B usando soros agrupados. Uma análise de custo-benefício. Rev Esp Enferm Dig 2006; 98: 112-121.
Introdução
Infecção pelo vírus da hepatite B (HBV) é uma doença que afecta milhões de pessoas em todo o mundo. Seu principal reservatório é o de portadores crônicos do VHB. Estima-se que cerca de 300 milhões de pessoas em todo o mundo estão infectadas por este vírus (1). As consequências médicas da infecção pelo HBV são variáveis e imprevisíveis, dependendo de fatores como a idade do paciente e o estado imunológico. O VHB é um agente etiológico bem reconhecido para hepatite crônica, cirrose hepática e carcinoma hepatocelular.
Grandes diferenças existem, entretanto, na prevalência da infecção, o que levou ao estabelecimento de três grandes áreas de alta, média e baixa endemicidade (2). Na maioria dos países desenvolvidos, a prevalência de portadores crônicos do VHB é inferior a 2% e a transmissão da infecção ocorre, sobretudo, em adultos pertencentes a determinados grupos de risco (usuários de drogas, homens homossexuais, heterossexuais promíscuos, trabalhadores da saúde) (3). Na Espanha, foi encontrada uma prevalência de 1,2% de portadores do VHB (4), sendo obrigatória a identificação do HBsAg em doadores de sangue, gestantes e indivíduos submetidos a programas de autotransfusão.
A técnica de pooling sérico tenta reduzir custos sem perder a eficácia, e tem sido utilizada principalmente em países em desenvolvimento na busca de anticorpos contra o vírus da imunodeficiência humana (HIV) (5-14), e o vírus da hepatite C (HCV) (15-19). Os resultados obtidos com este método têm se mostrado altamente promissores, pois diminuíram significativamente o custo dos testes laboratoriais sem diminuir significativamente sua sensibilidade.
O presente estudo tenta avaliar se a técnica de pooling sérico é aplicável na detecção do HBsAg para elucidar os fatores que podem modificar sua sensibilidade e para realizar uma análise custo-benefício para esta técnica diagnóstica.
Material e métodos
Determinação do HBsAg
O ensaio Imx HBsAg (Abbott Laboratories, Abbott Park, IL), que é um imunoensaio enzimático de terceira geração (EIA) qualitativo, foi utilizado para a avaliação do HBsAg. A presença ou ausência de HBsAg é determinada comparando a taxa de formação de produtos fluorescentes com um corte, que é calculado a partir da taxa de calibrador negativo (N) (não-reactivo ao plasma humano para o HBsAg). O ensaio Imx HBsAg calcula uma razão entre a taxa da amostra (S) e a taxa do calibrador negativo. O valor de corte (S/N) foi estabelecido como 2 para o EIA de soro único.
A técnica de pooling é realizada adicionando 200 mcL ao pool, ou seja, obtendo uma mistura de 40 mcL de cada um dos 5 soros que compõem o pool (diluição 1/5). O corte foi estabelecido como a média das amostras negativas mais 3 desvios padrão, resultando assim num valor de 1. Considera-se, portanto, que existe uma amostra não reactiva neste grupo de 5 quando o coeficiente S/N é < valor de corte, enquanto que um S/N pool > corte pode indicar a presença de pelo menos uma amostra reactiva. Neste caso, é necessário re-testar amostras individuais para identificar a(s) amostra(s) reativa(s). Todos os testes são realizados em duplicado.
De acordo com o acima exposto, a especificidade foi avaliada pelo HBsAg em 50 pools de 250 soros negativos. Para calcular a sensibilidade, 40 soros com a mesma distribuição de concentração da população geral da qual foram amostrados foram testados em um pool com 4 soros negativos.
Subtipos HBsAg (ad e ay)
O limite de detecção do Imx HBsAg para ad e ay foi avaliado usando soros de um painel de subtipos purificados do HBsAg (painel de sensibilidade à hepatite HBsAg, Abbott Laboratories). As concentrações de HBsAg/ad e HBsAg/ay variaram de 0,13 a 2,32 ng/mL e de 0,21 a 2,24 ng/mL, respectivamente. O limite de detecção foi determinado em um único e em uma piscina com 4 HBsAg soros negativos.
Influência do nível de anti-HBs
Para verificar se a existência de anticorpos anti-HBs nos soros estudados através do teste combinado poderia neutralizar o HBsAg e interferir com a sensibilidade da técnica, aplicamos o método de agrupamento de um soro com uma concentração conhecida de HBsAg/ad e HBsAg/ay com quatro soros com títulos conhecidos de anti-HBs.
A determinação quantitativa dos anti-HBs foi realizada com um método de imunoensaio enzimático de micropartículas (mEIA) utilizando um autoanalisador AxSYm (AxSYmTM AUSAB, Abbott Laboratories, Abbott Park, IL). Soros com altos títulos anti-HBs foram obtidos de controles pós-vacinação do VHB e pacientes que se recuperaram da hepatite B.
>
Pool-test in screening of HBsAg
>
A fim de avaliar a validade do teste de pool, foi realizada uma simulação de operações de campo usando o método acima em 1.525 amostras de soro obtidas de mulheres grávidas em um estudo anterior por nós para estimar a prevalência da infecção pelo HCV, e cujas amostras foram armazenadas a -20 ºC desde a coleta. Selecionamos aleatoriamente 300 amostras negativas de HBsAg e 14 positivas de HBsAg a partir destas. As determinações foram feitas sem conhecimento prévio da composição da piscina.
Redução em número de testes
Quando uma piscina tem resultado positivo, é necessário re-testar individualmente cada componente para identificar a amostra ou amostras que são HBsAg-positivas. Assim, quanto maior o número de pools positivos (ou seja, a prevalência do HBsAg), menor a redução no número de testes realizados.
Nesta base, a porcentagem de redução no número de testes quando se utilizou a triagem de soros combinados para o HBsAg, foi calculada sob as condições mais desfavoráveis e improváveis (baixa prevalência), ou seja, quando não havia mais de um soro positivo em nenhum dos pools. Por exemplo, para uma seroprevalência de 2% de HBsAg, se 100 soros forem analisados em 20 pools, 2 deles serão positivos. Assim, é necessário adicionar 10 determinações (10 soros testados individualmente) aos 20 iniciais (20 pools), o que resulta em 30 determinações no total. Neste exemplo, 70% do custo poderia ser economizado. Para realizar uma análise custo-benefício, o preço do teste HBsAg foi estimado em 3 dólares americanos para cada amostra. Isto sendo baseado no preço médio real do kit comercial em nosso hospital.
Análise estatística
Os dados foram coletados em um banco de dados e posteriormente analisados usando o pacote estatístico SPSS para Windows, Release 10.0. A correlação linear não paramétrica de Spearman foi empregada. Os resultados são expressos como média ± DP. Um nível de p < 0,05 foi considerado estatisticamente significativo.
Resultados
Nenhum dos 50 pools de soros HBsAg-negativos resultou positivo (pool S/N > 1), e os seguintes valores de pool S/N foram obtidos: 0,767 ± 0,076 (intervalo 0,67-0,88). Com esta amostra, a especificidade desta técnica de pooling foi portanto 100%. Por outro lado, todos os 40 soros HBsAg-positivos, quando determinados de forma agrupada, produziram valores S/N superiores a 1 (sendo a sensibilidade também 100%). O coeficiente de correlação entre as relações S/R para estas 40 amostras, como estudadas em amostra única e em pool, foi de 0,792 (p < 0,05).
Vinte e seis pontos seis por cento dos pools com amostras com altos títulos de HBsAg tinham uma relação S/R ainda maior do que a amostra única. Entretanto, o coeficiente de correlação de amostras com baixos títulos de HBsAg (S/N single < 25, n = 12) foi excelente (R = 0,9739, p < 0,05), como pode ser visto (Fig. 1).

O limite de detecção usando o método single foi 0.34 ng/mL para o subtipo ad e 0,29 ng/mL para o subtipo ay, enquanto para o método pooling foram detectados níveis mais baixos de antígeno: 0,20 ng/mL e 0,12 ng/mL, respectivamente. Os resultados da aplicação das técnicas single e pooled a soros com diferentes concentrações de HBsAg/ad e HBsAg/ay são mostrados (Fig. 2).
>
 >
>
>
Quando o título de anti-HBs na piscina é inferior a 100 IU/L, a técnica não perde a sensibilidade; mesmo quando os títulos de anti-HBs atingem 10.000 IU/L, a técnica ainda é capaz de detectar concentrações de HBsAg tão baixas quanto 1,5 ng/mL. A influência das diferentes concentrações de anti-HBs no limite de detecção dos subtipos de HBsAg quando se utiliza o método de pooling é apresentada (média de 2 determinações) (Fig. 3).
Na investigação realizada sob condições reais nos soros de gestantes, o método de pooling resultou na classificação correta de todas as amostras analisadas. Consequentemente, a sensibilidade e especificidade foram 100%.
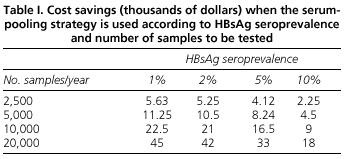
Há uma diminuição na percentagem de redução do número de testes obtidos com o método de pooling à medida que a seroprevalência do HBsAg aumenta. Pode-se observar que mesmo com prevalências do HBsAg tão altas quanto 10% na amostra estudada, uma economia mínima de pelo menos 30% é alcançada (Fig. 4).

A análise dos benefícios econômicos da estratégia de pooling sérico mostra que a economia obtida depende tanto da prevalência do HBsAg quanto do número de determinações a serem feitas. Assim, para países com uma prevalência baixa como o nosso, o método de pooling reduz o custo dos testes para o HBsAg. Por exemplo, estimamos que em 2.500 determinações realizadas em laboratório durante um ano usando o método de pooling, a economia será de 5.630 dólares americanos, e no caso de um hospital muito ocupado realizando 20.000 determinações anualmente, a economia atingirá 45.000 dólares americanos (Tabela I).
Discussão
Uma abordagem ao método de pooling é manter a diluição e o volume final da mistura de reacção em cada teste combinado, para não perder a sensibilidade, para a qual o diluente é reduzido, e parcialmente substituído pelos soros adicionais. Desta forma, não é necessário modificar o valor de corte em relação ao método padrão em amostras individualizadas. No entanto, o método utilizado no nosso estudo foi automatizado e a diluição da amostra foi realizada por um autoanalisador. Por este motivo, cada amostra apresenta uma diluição de 1 em 5 ao ser misturada com os outros 4 soros. Portanto, foi necessário em nosso estudo modificar o valor de corte e limitar o número de soros no pool para não perder a sensibilidade.
Quanto à especificidade, é necessário observar que o valor médio para pools foi apenas pouco mais de 3 desvios padrão do corte. Assim, um falso positivo pode ser esperado em cerca de 1% das ocasiões. Pensamos que isto é aceitável, pois a especificidade é quase 100% (99,9%). Um estudo com um maior número de amostras negativas de um grande número de diferentes indivíduos será necessário para estabelecer a verdadeira especificidade deste ensaio.
Embora a correlação entre o teste de amostra única e o teste de amostra combinada seja boa, a linha de regressão intercepta o eixo X a uma razão S/N de 3 (o valor Y correspondente é 1). Isto pode significar que qualquer amostra com uma relação S/N entre 2 e 3 no teste de amostra única teria um valor abaixo de 1 e, portanto, não seria detectada no teste combinado.
Para uma prevalência de 1% de soros HBsAg positivos, um modelo matemático descrito por Liu et al. (19) alcançou a redução máxima (80,5%) no número de testes para um tamanho de piscina de 11 soros. Entretanto, em nossa opinião, pode surgir um problema de especificidade devido ao efeito do pool na taxa de falso-positivo. Um aumento das proteínas não específicas, como resultado da mistura de soros, pode dar origem a um aumento da cor de fundo. Com o tamanho do pool de 5 escolhido para o nosso estudo, e a alteração do valor de corte de 2 para 1, não foram observadas perdas de sensibilidade (falsos negativos) ou especificidade (falsos positivos).
Os resultados do presente estudo mostram que a técnica de pooling de soros para a detecção do HBsAg é altamente sensível e específica, e também permite uma considerável economia econômica. Estes resultados são semelhantes aos obtidos por outros investigadores que aplicaram o método de pooling ao estudo do HCV e da infecção pelo HIV (5-19). Até o presente, apenas dois estudos (20,21) foram relatados sobre a aplicação do método de pooling ao estudo da infecção pelo HBV. Em um deles (20), realizado ao realizar o rastreamento pré-natal de rotina para hepatite B através do teste de 10 pools de amostras, os autores encontraram uma baixa prevalência de portadores crônicos (0,43%), e concluem que este é um método econômico e uma estratégia válida em áreas de baixa soroprevalência, com uma redução na sensibilidade estimada em 4,2%. A aplicação em nosso estudo do método pooling a gestantes, entre as quais a prevalência de portadores crônicos de HBsAg é de 0,93%, demonstrou uma sensibilidade e especificidade de 100%.
A distribuição dos dois principais subtipos de HBsAg (ad e ay) no nosso ambiente é de aproximadamente 50% para cada um, sendo mais frequente nos toxicodependentes que usam a via parenteral (22). Temos demonstrado que o método de agrupamento melhora a sensibilidade, ou seja, diminui o limite de detecção de um imunoensaio utilizado para a determinação dos dois principais subtipos do HBsAg. Nossa técnica de pooling permite detectar quantidades tão pequenas quanto 0,20 ng/mL de HBsAg/ad, e 0,12 ng/mL de HBsAg/ay, ainda inferiores às obtidas com o método padrão. O achado de sensibilidade aumentada com o teste de piscina não é surpreendente, pois isso foi relatado por outros autores (16). É importante avaliar a sensibilidade do kit de AIE utilizado para o teste de piscina, pois nem todos os kits podem ser adequados para o rastreamento de piscinas, como foi demonstrado no caso dos anticorpos contra o vírus da hepatite C (23,24).
A presença de anti-HBs nos soros da piscina poderia modificar a sensibilidade da técnica, mas apenas de forma significativa em títulos superiores a 10.000 UI/mL, observada apenas em amostras de estudos de controle pós-vacinação; nesta situação, a determinação do HBsAg não é indicada. De fato, Cunninghan et al. (20) constataram que apenas 4,5% dos pools constituídos por soros de gestantes tinham um título anti-HBs superior a 7.500 UI/L. Tendo em vista esta limitação à sensibilidade do método de pooling, eles descobriram que esta também estava em torno de 100% em sensibilidade e especificidade. Nossos resultados puderam ser reproduzidos em outras áreas de baixa prevalência, mas devem ser demonstrados previamente em áreas com alta endemicidade para o HBV. Nessas áreas, a maioria da população já está imunizada contra esse vírus, sendo possível que os títulos anti-HBs encontrados em soros estejam ligeiramente elevados.
Rabenau et al. (21) estudaram a segurança dos testes sorológicos em piscinas de plasma para o HBsAg utilizando um sistema de AIE semelhante ao nosso. Em seu estudo, a detecção do HBsAg foi influenciada pela presença de baixos títulos anti-HBs após 5 horas de incubação. Entretanto, após a dissociação do complexo imunológico, o HBsAg ainda era detectável na piscina, mesmo na presença de alto teor de anti-HBs. Em nosso estudo, demonstramos que apenas uma diminuição significativa na sensibilidade resulta em títulos de anti-HBs superiores a 10.000 UI/L. Estas diferenças podem ser devidas ao fato de que em nossos casos as amostras foram testadas sem incubação prévia. Isso poderia evitar a neutralização de antígenos pela formação de imunocomplexo.
Acreditamos, portanto, que tanto o título de anti-HBs no soro quanto o processamento pré-teste das amostras com AIA podem influenciar a sensibilidade do método de agrupamento. Todo laboratório que deseje utilizar esta técnica deve ter em mente estes dois fatores antes de implementar o uso geral.
OMS recomenda o uso do método de pooling sérico em caso de infecção pelo HIV, quando a prevalência da doença for inferior a 2%, e com um pooling máximo de 5 soros (25). Seguindo estas indicações, a maioria dos estudos se aplica e recomenda o uso de técnicas de pooling em áreas de baixa soroprevalência. No nosso estudo, demonstramos que o pooling de soros também pode ser rentável em populações com uma elevada prevalência de portadores de HBsAg. Isto poderia permitir o seu uso em países pertencentes a áreas de média e alta endemicidade para a infecção pelo HBV, que em geral coincide com países subdesenvolvidos ou em desenvolvimento, ou seja, aqueles que têm uma maior necessidade de reduzir os custos econômicos envolvidos nos testes laboratoriais. No entanto, será necessário realizar estudos semelhantes nestas áreas para confirmar os nossos resultados. No entanto, já foi demonstrado que em países como o Quênia, que tem uma alta freqüência de infecção pelo HIV (7,3%), a aplicação do pooling para sua detecção permitiria uma economia de 62%, sem perda significativa de segurança (14). Na Espanha, país pertencente a uma área de baixa endemicidade para a infecção pelo HBV, e com uma frequência de portadores de HBsAg na população geral de 1,2% (4), pode ser utilizado em todos os grupos em que o rastreio do HBsAg é actualmente obrigatório (tais como dadores de sangue, sujeitos submetidos a programas de autotransfusão, rastreio de mulheres grávidas).
O estudo custo-benefício da aplicação de técnicas de detecção de portadores crônicos de VHB permite demonstrar que a economia é maior quando feita em um grande número de determinações em grupos de baixa soroprevalência, e seu uso também pode ser econômico em áreas com alta prevalência de infecção, e mesmo em laboratórios que realizam um pequeno número de determinações. Temos demonstrado economia de custos de acordo com as diferentes prevalências de HBsAg e o número de testes a serem realizados anualmente. Em nossa área, a aplicação do método de pooling poderia economizar cerca de 74% dos custos econômicos totais quando comparado ao método único.
Alguns investigadores começaram recentemente a praticar estratégias para a detecção de ácidos nucléicos virais em doadores de sangue usando a reação em cadeia da polimerase (PCR), a fim de aumentar a segurança envolvida na transfusão de derivados do sangue (26-29). Devido ao facto de não ser possível efectuar rastreios individuais devido a problemas económicos e à quantidade de trabalho envolvido, o método de juntar amostras de sangue serologicamente negativo está agora a ser utilizado. Este procedimento pode aumentar a segurança do sangue através de um rastreio sistemático das dádivas de sangue a um custo relativamente baixo. Como uma das principais limitações na prática destes métodos é econômica, acreditamos que, com nosso estudo, poderia haver uma base teórica para o uso de triagem para infecções pelo HBV, HCV e HIV em dois estágios a um custo econômico relativamente baixo. Na primeira fase, uma AIA comercial poderia ser aplicada a um conjunto de soros doadores; na segunda fase, a aplicação de técnicas de PCR a um conjunto de amostras seronegativas poderia aumentar a segurança da análise. Até estudos futuros poderem comprovar o valor desta técnica com doadores de sangue, acreditamos que esta poderia ser aplicada apenas a testes diagnósticos e epidemiológicos.
Concluímos que a aplicação da AIA a soros agrupados é um método sensível e específico na detecção dos dois principais subtipos do HBsAg numa área de baixa seroprevalência. A sensibilidade só diminui quando existem títulos muito altos de anti-HBs nos soros agrupados. A técnica de pooling é um método que também pode permitir economias financeiras se empregado no estudo de populações com alta prevalência de portadores de HBsAg. Acreditamos que estudos adicionais são necessários para confirmar estes resultados.
Agradecimentos
Agradecemos a David H. Wallace (membro da Associação Européia de Editores Científicos e do Conselho de Editores Biológicos) pela tradução do manuscrito em inglês.
1. Maynard JE. Hepatite B: importância global e necessidade de controle. Vacina 1990; 8 (Supl.): 18s-20s.
2. Margolis HS, Alter MJ, Hadler SC. Hepatite B: evolução da epidemiologia e implicações para o controle. Sem Liver Dis 1991; 11: 84-92.
3. Alter MJ, Alter MJ, Mast EE. A epidemiologia da hepatite viral nos Estados Unidos. Gastroenterol Clin North Am 1994; 23: 437-55.
4. Suárez A, Riestra S, Navascués CA, et al. Positive HBsAg blood donors in Asturias (Spain): current prevalence and its significance. (resumo em inglês). Med Clin (Barcelona) 1994; 102: 329-32.
5. Emmanuel JC, Basset MT, Smith HJ, Jacobs JA. Pooling de soros para o teste do vírus da imunodeficiência humana (HIV): um método econômico para uso em países em desenvolvimento. J Clin Pathol 1988; 41: 582-5.
6. Kline RL, Brothers TA, Brookmeyer R, et al. Evaluation of human immunodeficiency virus seroprevalence in population surveys using pooled sera. J Clin Microbiol 1989; 27: 1449-52.
8. Frosner GG, Dobler G, von Sonnenburg FJ. Redução de custos de testes não ligados para o anti-HIV através da investigação de soros agrupados. AIDS 1990; 4: 73-5.
9. Behets F, Bertozzi S, Kasali M, et al. Uso bem sucedido de soros agrupados para determinar a soroprevalência do HIV-1 no Zaire com desenvolvimento de modelos de eficiência de custos. AIDS 1990; 4: 737-41.
10. Monzon OT, Paladin FJ, Dimaandal E, et al. Relevância do conteúdo de anticorpos e do formato do teste de HIV de soros agrupados. AIDS 1992; 6: 43-8.
11. Tamashiro H, Maskill W, Emmanuel J, et al. Reduzindo o custo da testagem de anticorpos anti-HIV. Lancet 1993; 342: 87-90.
12. Perriens JH, Magazani K, Kapila N, et al. Uso de um teste rápido e de um ELISA para a triagem de anticorpos anti-HIV de amostras de soro combinadas em Lubumbashi, Zaire. J Virol Methods 1993; 41: 213-21.
13. McMahon EJ, Fang C, Layug L, Sandler SG. Pooling blood donor samples to reduce the cost of HIV-1 antibody testing. Vox Sang 1995; 68: 215-9.
14. Verstraeten T, Farah B, Duchateau L, Matu R. Pooling sera para reduzir o custo da vigilância do HIV: um estudo de viabilidade em um distrito rural queniano. Trop Med Int Health 1998; 3: 747-50.
15. Kamel MA, Ghaffar YA, Wasef MA, et al. Alta prevalência de HCV em doadores de sangue egípcios. Lancet 1992; 340: 427.
16. Neil AGS, Conradie JD. Rastreio de baixo custo de doadores de sangue anti-HCV. Lancet 1992; 340: 1096.
17. Fernández E, Riestra S, García S, Rodríguez S. Testes em piscina para detecção da infecção pelo vírus da hepatite C. J Hepatol 1995; 23: 236.
18. García Z, Taylor L, Ruano A, et al. Evaluation of a pooling method for routine anti-HCV screening of blood donors to lower the cost burden on blood banks in countries under development. J Med Virol 1996; 49: 218-22.
19. Liu P, Shi ZX, Zhang YC, et al. A prospective study of a serum-pooling strategy in screening blood donors for antibody to hepatitis C virus. Transfusão de 1997; 37: 732-6.
20. Cunningham R, Northwood JL, Kelly CD, et al. Routine antenatal screening for hepatitis B using pooled sera: validation and review of 10 years experience. J Clin Pathol 1998; 51: 392-5.
21. Rabenau H, Schutz R, Berger A, et al. Qual a precisão dos testes serológicos dos pools de plasma para o antigénio de superfície do vírus da hepatite B, vírus da imunodeficiência humana 1 e 2, e vírus anti-hepatite C? (resumo em inglês). Infus Transfus 1996; 23: 124-30.
22. Echevarría JE, León P, López JA, et al. Distribuição do subtipo HBsAg entre diferentes populações de portadores do HBsAg na Espanha. Eur J Epidemiol 1995; 11: 39-45.
23. Neill AGS, Conradie JD. Testes em piscina para o vírus da hepatite C. Lancet 1994; 343: 738.
24. Liu P, Shi ZX, Zhang YC, Zhang XY. Estudo comparativo de 4 kits de AIE para triagem de anticorpos contra o vírus da hepatite C em soros agrupados. Biomed Environ Sci 1998; 11: 75-80.
25. Recomendações para o teste de anticorpos anti-HIV no pool de soro. WHO Weekly Epidemiol Rec 1991; 44: 316-27.
26. Lefrere JJ, Coste J, Defer C, et al. Screening blood donations for viral genomes: multicenter study of real-time simulation using pooled samples on the model of hepatitis C virus RNA detection. Transfusão de 1998; 38: 915-23.
27. Yerly S, Pedrocchi M, Perrin L. O uso da reação em cadeia da polimerase em pools de plasma para a detecção concomitante do vírus da hepatite C e do RNA tipo 1 do HIV. Transfusão 1998; 38: 908-14.
28. Schottstedt V, Tuma W, Bunger G, Lefevre H. PCR para experiências de HBV, HCV e HIV-1 e primeiros resultados de um programa de triagem de rotina em um serviço de transfusão de sangue grande. Biologicals 1998; 26: 101-4.
29. Morandi PA, Schockmel GA, Yerly S, et al. Detecção do vírus da imunodeficiência humana tipo 1 (HIV-1) RNA em pools de soros negativos para anticorpos para HIV-1 e HIV-2. J Clin Microbiol 1998; 36: 1534-8.
Deixe uma resposta