O que têm em comum as experiências de imunoprecipitação de DNA mini e proteínas? Eles começam de forma diferente, mas terminam com o mesmo estágio crítico – a eluição. Mas o que é exactamente a eluição, e qual é o objectivo?
A terminologia
Primeiro, vamos começar com alguma terminologia básica:
Eluição – extrair um material de outro por lavagem com um solvente.
O adsorvente – uma fase sólida, que pode ser um gel de sílica no caso de mini-colunas de preparação, mas geralmente contas que podem ser ligadas covalentemente a anticorpos ou outras moléculas de ligantes. A “fase sólida” não significa necessariamente uma coluna de pé; pode ser contas num eppendorf que são fáceis de lavar.
Afinidade – uma medida da capacidade do absorvente de ligar a molécula de escolha (o que você está tentando eluir). Quanto maior a afinidade da fase sólida com a biomolécula de escolha (BOC), mais apertada a molécula se liga a ela. Contudo, você não quer que a ligação seja irreversível; isto tornará a eluição impossível.
Eluente – um solvente que remove o BOC do absorvente.
Eluir – o solvente contendo BOC removido do adsorvente.
Preparação do material
Antes da eluição, você precisa absorver a molécula de escolha enquanto se livra da contaminação. Este é um passo essencial, como a sabedoria convencional nos lembra “o lixo entra, o lixo sai”. Você pode ter excelentes reagentes para a eluição, mas se a sua amostra contém muito do pessoal não relacionado (o termo científico é “gunk”), ela irá entupir o material de adsorção. A saturação da fase sólida impedirá que o seu BOC absorva e depois contamine o eluato. As etapas eficazes de lise e limpeza são essenciais para o sucesso da sua experiência de eluição.
É importante determinar o volume do seu material de pré-absorção. O volume do lisado que passa pelo meio de absorção não deve exceder 3 – 5 volumes da coluna. O grande volume de lisado que passa através do meio absorvente aumenta o tempo do experimento, assim como a probabilidade de absorção de graxa. Em muitos casos, vale a pena reduzir o volume inicial do lisado por filtração ou fracionamento. Assim, o volume do lisado determina o tamanho da coluna.
A escolha do material de adsorção depende da composição química da sua molécula de interesse. A absorção de biomoléculas geralmente envolve uma interação mais ou menos específica entre o substrato e a molécula. Por exemplo, o DNA é absorvido em mini-colunas devido à interação iônica entre grupos de fosfato de DNA carregados negativamente e partículas de sílica carregadas positivamente.
Proteínas são geralmente adsorvidas em contas sépticas ou magnéticas cobertas em IgG.
Após uma aplicação inicial do lisado, em nenhum ponto sua coluna pode secar. Isto irá “cozer a sua” molécula ao absorvente e perturbar a integridade da coluna. Se não tiver tempo para continuar a experiência, encha a coluna com um tampão compatível e pare o fluxo.
Lavagem
O objectivo da lavagem da fase sólida é remover um material não relacionado, deixando a molécula de interesse na coluna. A separação selectiva é frequentemente conseguida utilizando um tampão com baixa força iónica (por exemplo, baixa concentração de sal). O volume do tampão de lavagem deve estar próximo da quantidade do material inicial e ser pelo menos 3-5 volumes da coluna.
No entanto, após vários volumes do tampão de lavagem terem passado pela coluna, as contaminações serão lavadas e qualquer lavagem adicional não melhorará a qualidade da sua preparação. Além disso, você começará a perder seu material alvo.
Eluição
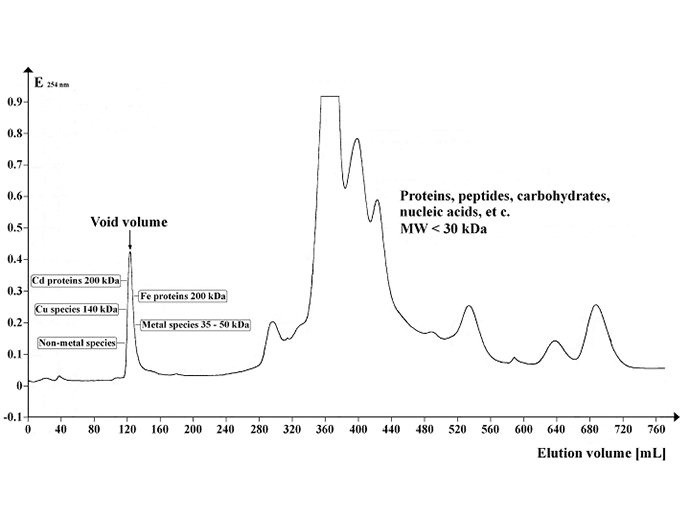
Imagem: Cromatograma mostrando o perfil de absorção UV do sobrenadante Arabidopsis separado no Sephadex G-50 Superfine. Volume de gel: 500 mL; comprimento da coluna: 700 mm; diâmetro da coluna: 30 mm; taxa de fluxo eluente: 12 mL / hr; volume da fracção: 8.0 mL; número de fracções: 95; volume da amostra: 5 mL; temperatura de separação: 4 °C; tampão de eluição: 20 mM Tris-HCl, 1 mM NaN3; pH 8,0. Crédito da imagem: https://commons.wikimedia.org/wiki/File:Chrom_SephG-50.tif
A própria eluição funciona porque perturba as ligações entre a coluna e o substrato (ou seja, usando sal alto ou alta temperatura do eluente). A eluição é normalmente feita num pequeno volume de tampão compatível com o armazenamento de amostras e outras aplicações.
A eluição de ADN da mini coluna de preparação é o caso mais simples: um volume de tampão remove quase todo o ADN. A concentração de ADN no eluato é inversamente proporcional ao buffer de eluição utilizado: quanto mais buffer utilizar, menor será a concentração final de ADN. Entretanto, mesmo neste caso, a maioria dos fabricantes recomenda o uso de um volume adicional para remover todo o DNA.
Para as colunas, a velocidade de eluição é crítica. Velocidade muito lenta aumentará as chances de degradação da molécula; muito rápida e não haverá resolução de frações.
Para colunas de grande volume, você precisa coletar frações eluídas porque a sua molécula será distribuída entre elas. A primeira fração conterá uma mistura de tampão de lavagem e eluição e possível contaminação não removida pelo tampão de lavagem.
Você pode monitorar DO para seu tipo de molécula (260nm/280nm para DNA) e fazer um blot para sua concentração de molécula específica em cada fração. No caso mais simples, sua distribuição de moléculas seguirá uma curva sinusoidal simples, mas pode ter um ou mais picos agudos.
Em conclusão, conhecendo os parâmetros básicos de sua experiência (absorvente, tamanho da coluna, tampão de lavagem, tampão de eluição, taxa de fluxo, número das frações) e os princípios gerais de eluição lhe permitirão configurar com sucesso sua eluição.
Para mais detalhes, encontre um artigo onde os outros cientistas fizeram algo semelhante – idealmente a mesma molécula, mas uma semelhante serve – e se adapte à sua condição.
Deixe uma resposta