Os elementos do grupo 13 incluem os metais pós-transição.
O termo metais pós-transição refere-se aos elementos que são metais que seguem os metais de transição. Como no conceito metalóide, não há consenso universal sobre o que é exatamente um metal pós-transição. Felizmente, na prática é menos importante definir com precisão o que é e não é um metal pós-transição do que compreender a razão pela qual poderia ser útil classificar os elementos como um metal pós-transição.
As principais características dos metais pós-transição são que eles são relativamente ricos em electrões e electronegativos em comparação com o que é classicamente pensado como um metal. Grosso modo, isto traduz-se em pontos de fusão relativamente mais baixos (uma vez que mais níveis antiboinding na estrutura da banda tendem a ser ocupados), maior preferência pela covalência, e maior fragilidade do que outros metais (devido à ligação direccional resultante). A sua riqueza em electrões significa que tendem a formar catiões macios.
Vários sistemas são utilizados para classificar os elementos como pertencentes aos metais de pós transição. Os principais incluem:
- Metais que seguem o d-bloco. Por esta definição estão incluídos apenas os metais dos grupos 13 e superiores e as linhas 3 e superiores que formam cátions relativamente macios e ricos em electrões e que apresentam uma covalência significativa na sua ligação. No entanto, se este esquema for adotado com muita rigidez, Al é excluído, uma vez que tecnicamente não segue o bloco d (e tem uma sub-capa (n-1)d não preenchida) e os metalóides são excluídos, embora muitos deles também formem cátions relativamente moles e ricos em elétrons com sub-capa (n-1)d preenchida. Outra desvantagem deste sistema é que ele enreda a questão de quais elementos devem ser classificados como metais pós-transição com a espinhosa questão de quais elementos devem ser classificados como metais vs. metalóides.
- Metais e metalóides do bloco p. Este sistema tem a vantagem de enfatizar as propriedades interessantes e únicas dos metais e metalóides do bloco p, assim como as continuidades nessas propriedades através do bloco p. Consequentemente, ele será utilizado nas seções que se seguem. Entretanto, tem a desvantagem de excluir metais como Zn, Cd, e Hg, os quais, em muitos compostos em que o metal tem uma configuração (n-1)d10.
- Metais que seguem os elementos de transição no sentido de formar íons com uma casca de valência completamente cheia (n-1)d, às vezes junto com Al e os metalóides do bloco p. Esta definição adiciona Zn, Cd, e Hg (e às vezes Cu, Ag, e Au) já que eles formam íons com uma configuração eletrônica de (n-1)d 10 valências, como Zn2+, Cd2+ e Hg2+(e Cu+, Ag+, e Au+). Como este capítulo considera apenas os elementos p-block para os fins deste capítulo, este sistema é funcionalmente idêntico ao sistema 2.
Qualquer que seja o esquema de classificação utilizado, é muitas vezes mais útil pensar na classificação dos elementos como metais pós-trânsito como uma forma de enfatizar as semelhanças nas propriedades químicas de um conjunto de elementos do que como uma forma de enfatizar como os metais pós-trânsito diferem de outros metais. Os metais pós-transição não são os únicos que formam cátions macios ou compostos melhor descritos como sendo mantidos juntos por ligações covalentes. Como as seções anteriores deixaram claro, mesmo os metais alcalinos formam ânions nas circunstâncias certas e muitos compostos de metais são melhor descritos em termos de covalência do que as interações iônicas. Isto já era evidente na química dos metais alcalinos da terra Be e Mg discutidos na secção anterior. Nos capítulos seguintes, a ligação e reatividade em complexos de coordenação e compostos organometálicos será em grande parte descrita em termos covalentes.
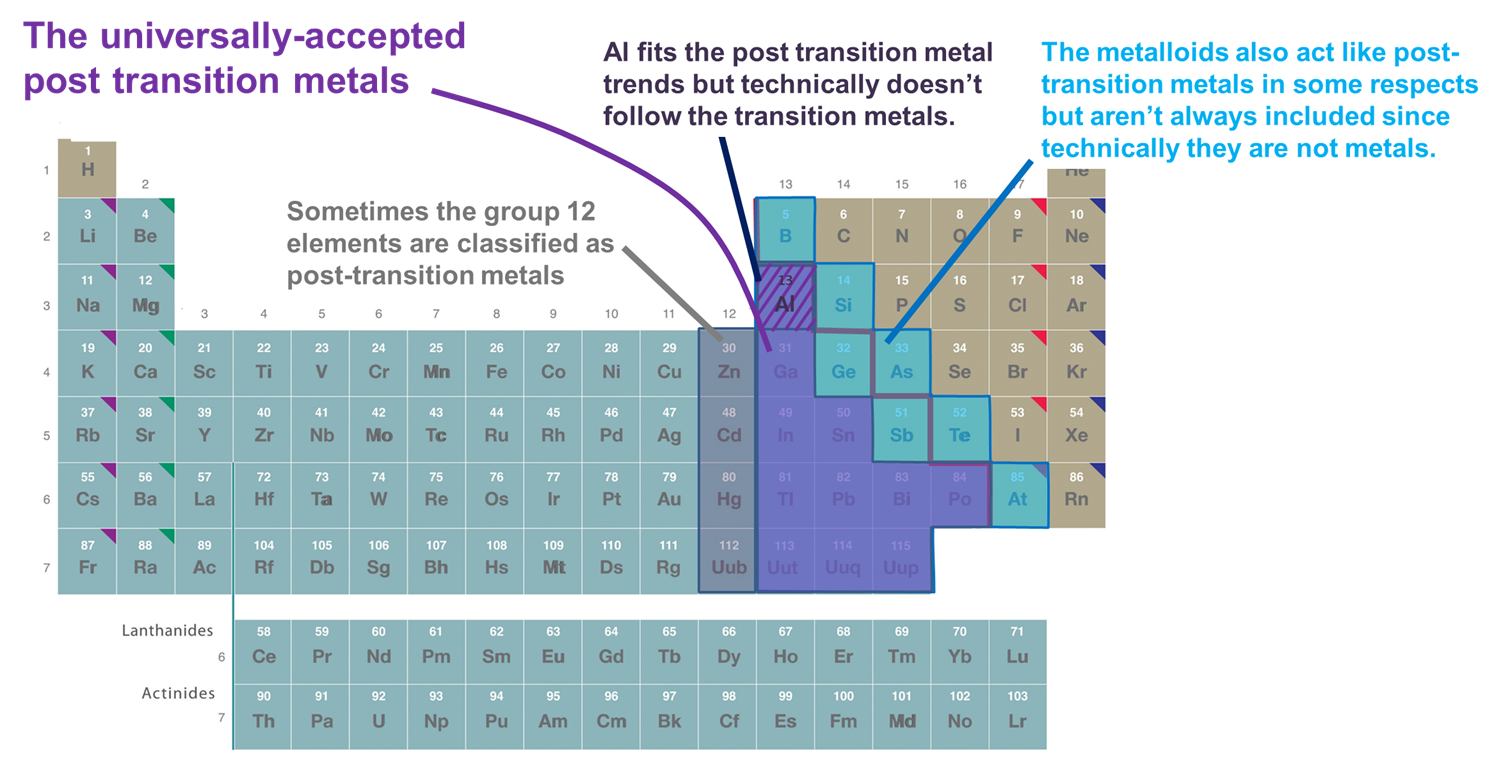
Figure {\F_PageIndex{2}}). Alguns dos elementos classificados como metais pós transição. Os mostrados em roxo são comumente aceitos, pois são metais e seguem claramente os metais de transição, enquanto os metais dos grupos 12 (e às vezes 11), Al, e os metalóides são todos às vezes incluídos, pois se comportam como os outros metais pós-transição em aspectos importantes. A tabela periódica é adaptada a partir daí em https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molecules%2C_and_Ions/2,5%3A_The_Periodic_Table.
Deixe uma resposta