Molecular Dipole Moments
Em moléculas contendo mais de uma ligação polar, o momento molecular dipolo é apenas a combinação vetorial do que pode ser considerado como “momentos dipolo de ligação” individuais. Matematicamente, os momentos dipolo são vetores; eles possuem tanto uma magnitude quanto uma direção. O momento dipolo de uma molécula é, portanto, a soma vectorial dos momentos dipolo das ligações individuais na molécula. Se os momentos dipolo das ligações individuais se anulam mutuamente, não há momento dipolo líquido. É o caso do CO2, uma molécula linear (Figura 1a)). Cada ligação C-O no CO2 é polar, mas experimentos mostram que a molécula de CO2 não tem momento dipolo. Como os dois dipolos de ligação C-O em CO2 são iguais em magnitude e orientados a 180° um para o outro, eles cancelam. Como resultado, a molécula de CO2 não tem momento dipolo líquido, apesar de ter uma separação substancial de carga. Em contraste, a molécula H2O não é linear (Figura 1b); ela é dobrada no espaço tridimensional, de modo que os momentos dipolo não se cancelam mutuamente. Assim, uma molécula como a H2O tem um momento dipolo líquido. Esperamos que a concentração da carga negativa esteja no oxigénio, o átomo mais electronegativo, e a carga positiva nos dois hidrogénios. Esta polarização de carga permite que o H2O se ligue a hidrogênio a outras espécies polarizadas ou carregadas, incluindo outras moléculas de água.
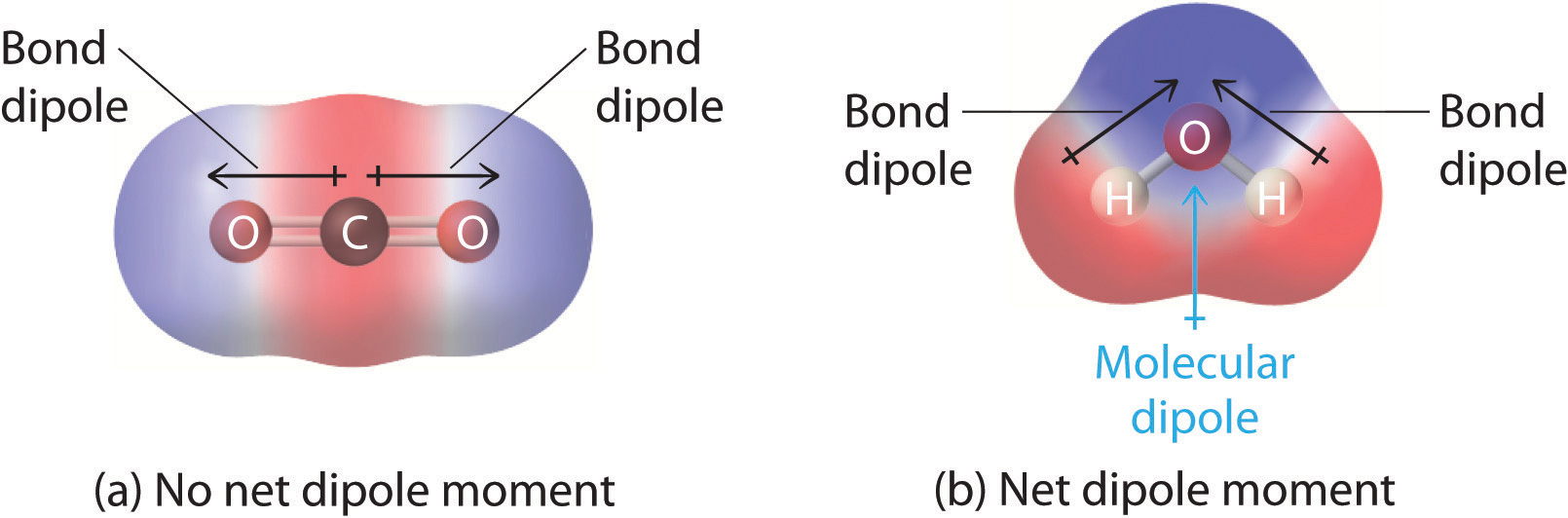
Figure \(\PageIndex{1}}: Como Momentos Dipolares de Ligação Individuais são Adicionados Juntos para Dar um Momento Dipolo Molecular Global para Duas Moléculas Triatômicas com Estruturas Diferentes. (a) No CO2, os dipolos de ligação C-O são iguais em magnitude, mas orientados em direções opostas (a 180°). Sua soma vetorial é zero, portanto, o CO2 não tem dipolo líquido. (b) Em H2O, os dipolos de ligação O-H também são iguais em magnitude, mas estão orientados em 104,5° entre si. Portanto a soma vetorial não é zero, e H2O tem um momento dipolo líquido.
A equação a seguir é simplificada para um sistema simples de duas cargas separadas que está presente em moléculas diatômicas ou quando se considera um dipolo de ligação dentro de uma molécula.
Este dipolo de ligação, µ (grego mu) é interpretado como o dipolo de uma separação de carga ao longo de uma distância entre as cargas parciais ^(Q^++) e ^(Q^-) (ou os termos mais comumente usados ^(δ^++) – ^(δ^-)); a orientação do dipolo está ao longo do eixo da ligação. As unidades nos momentos dipolo são tipicamente debyes (D) onde um debye é igual a 3,336 x 1030 coulomb metros (C – m) em unidades SI. Considere um sistema simples de um único elétron e próton separado por uma distância fixa. A unidade de carga em um elétron é 1,60 X 1019 C e o próton & elétron estão separados por 100 pm (aproximadamente o comprimento de uma ligação covalente típica), o momento dipolo é calculado como:
\ &= (1,60 ^{-19}\, C)(1,00 ^{-10} ^,m) ^ sem número ^{-29} ^{-1921>= 1,60 ^{-29} \Cdot mabel… \Fim [alinhamento]
&= 4,80>; D {3}label} \D) é um valor de referência chave e representa uma carga pura de +1 e -1 separada por 100 horas. No entanto, se a separação da carga for aumentada então o momento dipolo aumenta (linearmente):
- Se o próton e o elétron forem separados por 120 pm:
- Se o próton e o electrão fossem separados por 150 pm:
- Se o próton e o electrão fossem separados por 200 pm:
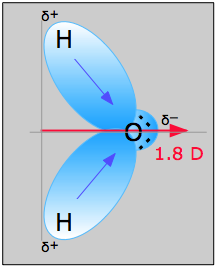
Exemplo \(\PageIndex{1}}): Água
>
A molécula da água na figura {1}(\PageIndex{1}}) pode ser usada para determinar a direcção e magnitude do momento dipolo. A partir das electronegatividades de oxigênio e hidrogênio, a diferença é de 1,2e para cada uma das ligações hidrogênio-oxigênio. A seguir, como o oxigénio é o átomo mais electronegativo, exerce uma maior atracção sobre os electrões partilhados; tem também dois pares solitários de electrões. A partir disso, pode-se concluir que o momento dipolo aponta de entre os dois átomos de hidrogênio para o átomo de oxigênio. Usando a equação acima, o momento dipolo é calculado como 1,85 D multiplicando a distância entre os átomos de oxigênio e hidrogênio pela diferença de carga entre eles e então encontrando os componentes de cada um desses pontos na direção do momento dipolo líquido (o ângulo da molécula é 104.5˚).
O momento de ligação da ligação O-H =1,5 D, portanto o momento dipolo líquido é
\
Deixe uma resposta