14.8 Éteres
Objectivos de aprendizagem
- Descrever a diferença estrutural entre um álcool e um éter que afecta as características físicas e a reactividade de cada um.
- Nome éter simples.
- Descrever a estrutura e usos de alguns éteres.
Com a fórmula geral ROR′, um éterUm composto orgânico que tem um átomo de oxigénio entre dois grupos de hidrocarbonetos. pode ser considerado um derivado da água em que ambos os átomos de hidrogénio são substituídos por grupos alquilo ou arilo. Também pode ser considerado um derivado de um álcool (ROH) no qual o átomo de hidrogênio do grupo OH é substituído por um segundo grupo alquilo ou arilo:
HOH→H atomsreplace bothROR′←of OH groupreplace H atomROH
Éteres simples têm nomes comuns simples, formados a partir dos nomes dos grupos ligados ao átomo de oxigênio, seguidos pelo nome genérico éter. Por exemplo, CH3-O-CH2CH2CH3 é éter metilpropílico. Se ambos os grupos forem o mesmo, o nome do grupo deve ser precedido pelo prefixo di-, como no éter dimetílico (CH3-O-CH3) e éter dietílico CH3CH2-O-CH2CH3.
As moléculas de éter não têm átomo de hidrogénio no átomo de oxigénio (ou seja, sem grupo OH). Portanto, não há ligação intermolecular de hidrogênio entre as moléculas de éter e, portanto, os éteres têm pontos de ebulição bastante baixos para uma determinada massa molar. De facto, os éteres têm pontos de ebulição aproximadamente iguais aos dos alcanos de massa molar comparável e muito inferiores aos dos álcoois correspondentes (Tabela 14.4 “Comparação dos pontos de ebulição de alcanos, álcoois e éteres”).
Tabela 14.4 Comparação dos pontos de ebulição de alcanos, álcoois e éteres
| Fórmula estrutural condensada | Nome | Massa solar | Ponto de ebulição (°C) | Ligação intermolecular de hidrogênio em líquido puro? |
|---|---|---|---|---|
| CH3CH2CH3 | propano | 44 | -42 | não |
| CH3OCH3 | éter dimetil | 46 | -25 | no |
| CH3CH2OH | Álcool etílico | 46 | 78 | yes |
| CH3CH2CH2CH2CH2CH3 | pentano | 72 | 36 | no |
| CH3CH2OCH2CH3 | éter dietético | 74 | 35 | no |
| CH3CH2CH2CH2OH | Álcool butílico | 74 | 117 | yes |
Outras moléculas têm um átomo de oxigénio, no entanto, e se envolver na ligação de hidrogênio com moléculas de água. Consequentemente, um éter tem aproximadamente a mesma solubilidade em água que o álcool que é isomérico com ele. Por exemplo, éter dimetílico e etanol (ambos com a fórmula molecular C2H6O) são completamente solúveis em água, enquanto éter dietílico e 1-butanol (ambos com C4H10O) são pouco solúveis em água (8 g/100 mL de água).
Exemplo 5
Qual é o nome comum para cada éter?
- CH3CH2CH2OCH2CH2CH3
-
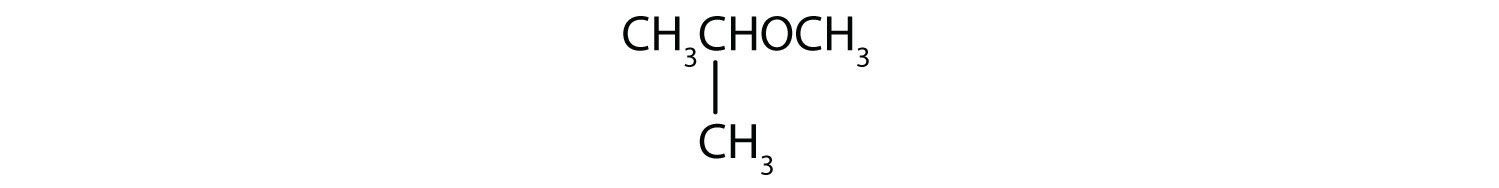
Solução
- Os grupos de carbono de cada lado do átomo de oxigénio são grupos propílicos (CH3CH2CH2), por isso o composto é éter dipropílico.
- O grupo de três átomos de carbono é ligado pelo átomo de carbono médio, portanto é um grupo isopropílico. O grupo de um-carbono é um grupo metílico. O composto é éter isopropílico metílico.
Exercício de Construção de Silício
-
CH3CH2CH2CH2CH2CH2CH2CH3
-
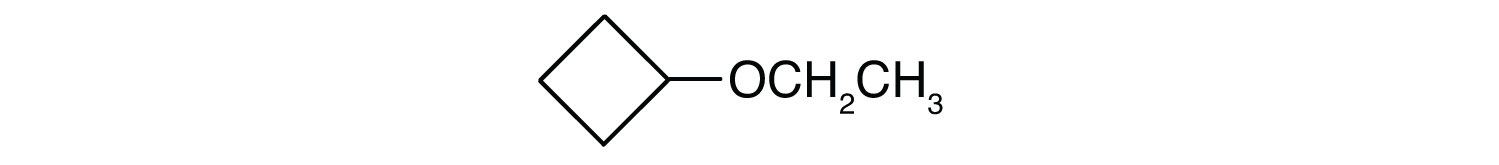
Qual é o nome comum para cada éter?
À Sua Saúde: Éteres como Anestésicos Gerais
Um anestésico geral age no cérebro para produzir inconsciência e uma insensibilidade geral ao sentimento ou dor. O éter dietílico (CH3CH2OCH2CH3) foi o primeiro anestésico geral a ser usado.
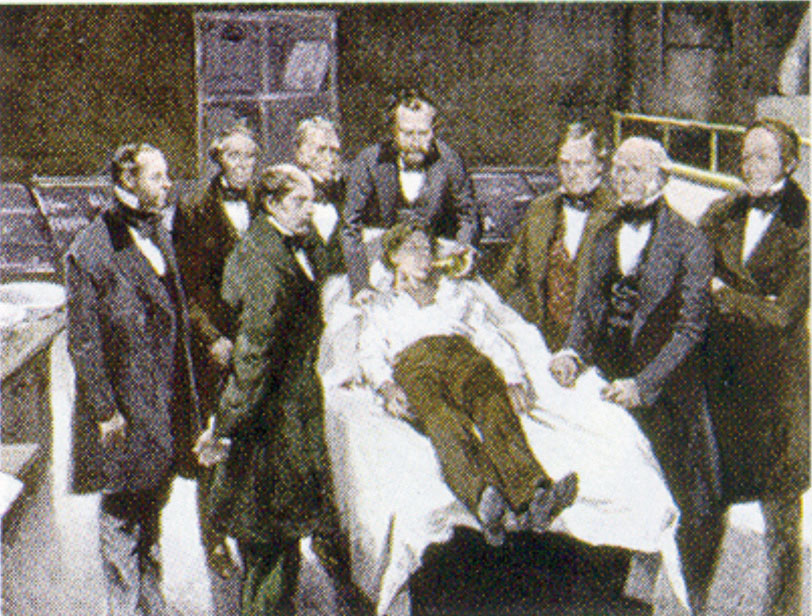
William Morton, um dentista de Boston, introduziu o éter dietílico na prática cirúrgica em 1846. Esta pintura mostra uma operação em Boston, em 1846, na qual o éter dietílico era usado como anestésico. A inalação do vapor de éter produz inconsciência ao deprimir a atividade do sistema nervoso central.
Source: Pintura de William Morton por Ernest Board, de http://commons.wikimedia.org/wiki/File:Morton_Ether_1846.jpg.
Éter dietílico é relativamente seguro porque há uma grande diferença entre a dose que produz um nível eficaz de anestesia e a dose letal. Entretanto, por ser altamente inflamável e ter a desvantagem adicional de causar náuseas, foi substituído por anestésicos inalantes mais recentes, incluindo os compostos contendo flúor halotano, enflurano e isoflurano. Infelizmente, a segurança destes compostos para o pessoal da sala de cirurgia tem sido questionada. Por exemplo, as operárias expostas ao halotano sofrem uma taxa de abortos espontâneos superior à das mulheres na população em geral.
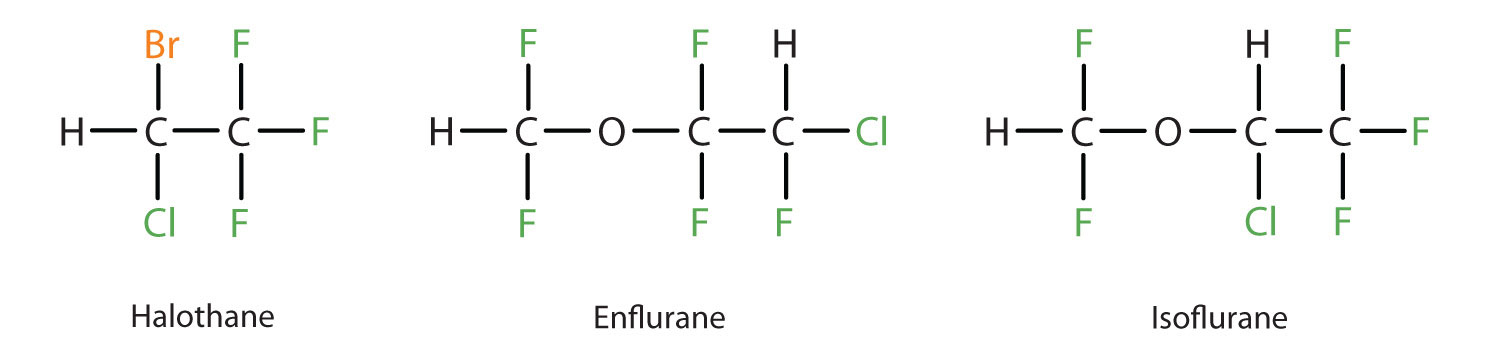
Estes três compostos anestésicos modernos, inalantes e contendo halotano são menos inflamáveis do que o éter dietílico.
Exercícios de revisão de conceitos
-
Por que é que o éter dietílico (CH3CH2OCH2CH3) tem um ponto de ebulição muito inferior ao do 1-butanol (CH3CH2CH2CH2OH)?
-
Que é mais solúvel em éter etílico de água (CH3CH2OCH3) ou em 1-butanol (CH3CH2CH2CH2OH)? Explique.
Respostas
-
Éter dietílico não tem ligação intermolecular de hidrogénio porque não há grupo OH; o 1-butanol tem um OH e está envolvido na ligação intermolecular de hidrogénio.
-
Éter metílico etílico (três átomos de carbono, um átomo de oxigénio) é mais solúvel em água do que o 1-butanol (quatro átomos de carbono, um átomo de oxigénio), apesar de ambos se poderem ligar ao hidrogénio com água.
Key Takeaways
- Para dar nomes comuns aos éteres, basta nomear os grupos ligados ao átomo de oxigénio, seguido do nome genérico éter. Se ambos os grupos forem o mesmo, o nome do grupo deve ser precedido pelo prefixo di-.
- As outras moléculas não têm grupo OH e, portanto, nenhuma ligação intermolecular de hidrogênio. Portanto, os éteres têm pontos de ebulição bastante baixos para uma determinada massa molar.
- Outras moléculas têm um átomo de oxigênio e podem se ligar ao hidrogênio com moléculas de água. Uma molécula de éter tem aproximadamente a mesma solubilidade em água que o álcool que é isomérico com ela.
Exercícios
-
Como pode o etanol dar dois produtos diferentes quando aquecido com ácido sulfúrico? Diga o nome destes produtos.
-
Qual destes éteres é isomérico com etanol-CH3CH2OCH2CH3, CH3OCH2CH3, ou CH3OCH3?
-
Nome cada composto.
- CH3OCH2CH2CH3
-
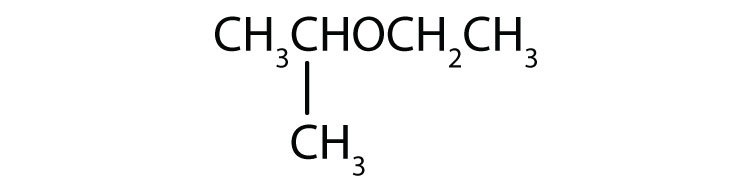
-
Nome cada composto.
- CH3CH2CH2CH2OCH3
- CH3CH2OCH2CH2CH3
-
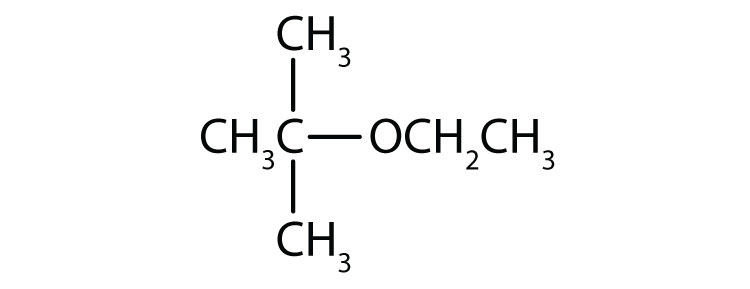
Diga a estrutura para cada composto.
- Éter etílico metil
- Éter etílico terc-butil
-
Desenhar a estrutura para cada composto.
- éter diisopropílico
- éter propílico ciclopropílico
Respostas
-
Desidratação intramolecular (tanto o H como o OH provêm da mesma molécula) dá etileno; a desidratação intermolecular (o H vem de uma molécula e o OH vem de outra molécula) dá éter dietílico.
-
- Éter metil propílico
- Éter etil-isopropílico
-
- CH3OCH2CH3
-
Deixe uma resposta