Introduction
L’embolie pulmonaire (EP) est une maladie fréquente avec une incidence annuelle de 110 cas pour 100 000 adultes,1 qui a augmenté au cours des dernières années.1,2 Les symptômes peuvent varier, allant d’un état asymptomatique à un choc obstructif suite à un collapsus circulatoire.3 La mortalité globale est non seulement élevée, mais aussi très variable. Dans une étude récente, la mortalité globale était de 8,65 % à trois mois.4 Les artères centrales sont le plus souvent touchées,5,6 tandis que l’EP sous-segmentaire représente 4 à 7 % des cas.7-9 Cependant, un certain nombre d’études font état d’une atteinte sous-segmentaire chez jusqu’à 30 % des patients.9
La pertinence clinique de l’étendue de l’EP est encore discutable, et le rôle de l’anticoagulation chez les patients présentant une atteinte sous-segmentaire a été contesté dans un certain nombre d’études.10,11
L’objectif de notre étude était de décrire les particularités cliniques des patients atteints d’EP dans notre hôpital et d’analyser leur pronostic en fonction de l’étendue de la maladie.
Méthodes
Nous avons mené une étude rétrospective de tous les patients âgés de plus de 18 ans avec un diagnostic confirmé d’EP par scanner thoracique12 au complexe hospitalier de Pontevedra en Espagne entre janvier 2005 et décembre 2010. Le suivi s’est terminé le 31 janvier 2012, date limite de survie. Ainsi, le suivi minimum était de 14 mois. Les données administratives des sorties d’hôpital codées ont été utilisées pour la sélection des patients. Les patients dont les données étaient incomplètes et/ou dont le diagnostic avait été établi par des méthodes autres que le scanner thoracique ont été exclus de l’échantillon initial de 470 patients. Ainsi, 313 cas ont été inclus dans l’étude.
Les données suivantes ont été analysées :
-
Détails personnels : âge, sexe, tabagisme actif et obésité (indice de masse corporelle >30).
-
Données cliniques, examen physique et tests complémentaires : chirurgie récente, anesthésie, traumatisme, cancer, voyage et/ou immobilisation prolongée ; paralysie des membres inférieurs ; insertion d’un cathéter central, thrombophilie ou syndrome des antiphospholipides ; antécédent de maladie thromboembolique veineuse (MTEV) ; varices des membres inférieurs ; grossesse, contraception ou hormonothérapie. Tachypnée, râle crépitant, signes de TVP des membres inférieurs ; signes vitaux, hypotension systolique (SBP
100mmHg), hypotension diastolique (DBP60mmHg) et tachycardie (fréquence cardiaque>100).13,14 Analyse des gaz du sang artériel, hémoglobine, hématocrite, numération plaquettaire, leucocytose, neutrophilie, glucose, urée, créatinine, sodium, potassium et fibrinogène, stratifiés comme normaux ou anormaux selon les valeurs de référence du laboratoire de notre hôpital. Les taux de D-dimères ont été déterminés par un test immunologique turbidimétrique de haute sensibilité. Les taux de D-dimères supérieurs à 500ng/ml ont été considérés comme pathologiques. La fonction rénale a été considérée comme normale avec un taux de filtration glomérulaire supérieur à 60ml/min/1,73m2 selon l’équation MDRD abrégée.15 Résultats électrocardiographiques et d’imagerie : radiographie thoracique simple ; écho-Doppler des membres inférieurs (complet ou distal) a été réalisé à la discrétion du radiologue, en fonction de la présentation clinique du patient. Les EP ont été rassemblés et classés en trois groupes à l’aide du scanner thoracique : central (tronc principal, artère pulmonaire droite ou gauche, artères intermédiaires ou lobaires), segmentaire et sous-segmentaire. La localisation du thrombus a été déterminée en fonction de la plus grande artère impliquée. Comorbidité mesurée par l’indice de Charlson (CCI), catégorisée en « 0 », « 1-2 » et « ≥3 ».16
La probabilité clinique a été déterminée avec les scores de Wells17 et de Genève18.
La cause du décès a été attribuée par l’investigateur principal sur la base des dossiers médicaux disponibles et catégorisée en trois groupes : lié à l’EP, non lié à l’EP, et inconnu. La discordance entre les données et les diagnostics finaux incertains a été résolue par une discussion avec les collecteurs de données.
Analyse statistique
Les données des variables catégorielles sont présentées sous forme de fréquences (pourcentages) ; les données des variables continues sont présentées sous forme de médianes et d’intervalles interquartiles.
Les tests exacts de Fisher et du Chi carré ont été utilisés pour comparer les variables catégorielles. Entre les groupes, les variables continues ont été comparées par ANOVA ou par le test de Kruskal-Wallis en cas de distributions non normales.
Les courbes de survie et les augmentations de la probabilité de décès ont été respectivement calculées avec le test de Kaplan-Meier et la régression de Cox. Les différences ont été considérées comme significatives à p
0,05. Les données ont été analysées avec SPSS 15 pour Windows.Résultats
L’étude a inclus 313 patients atteints d’EP ; 56% étaient des femmes et l’âge médian était de 70 ans (intervalle interquartile 53-78 ans). L’EP centrale représentait 68% des cas ; l’EP segmentaire et sous-segmentaire, 25% et 7%. Les patients atteints d’EP sous-segmentaire étaient plus jeunes, présentaient une comorbidité moindre et aucun d’entre eux ne présentait de TVP proximale (tableau 1). Les patients du groupe d’EP sous-segmentaire comprenaient 10 (45%) avec une seule EP et 12 (55%) avec des EP multiples.
Pour ce qui est des symptômes, la dyspnée est la plus fréquente chez les patients avec une EP centrale, et la douleur est également fréquente dans les EP segmentaires et sous-segmentaires (Tableau 1). La comorbidité mesurée par l’ICC était présente dans 78% des cas, et était plus fréquente dans l’EP centrale (Tableau 1). 22 % des patients avaient reçu un diagnostic de cancer avant l’EP (données non présentées). En ce qui concerne la présence de facteurs de risque et la probabilité clinique d’EP selon les scores de Wells et de Genève, aucune différence n’a été trouvée sur l’étendue de la maladie (tableau 1). En ce qui concerne les examens complémentaires, les patients présentant une atteinte de l’artère centrale ont montré des valeurs de D-dimères significativement plus élevées et ont obtenu de moins bons résultats à l’analyse des gaz du sang. Aucune différence significative n’a été trouvée dans les autres paramètres (tableau 2). Tous les patients ont été admis à l’hôpital et traités par anticoagulants.
La mortalité à 30 jours était de 7%, attribuable à l’EP dans 3,5% des cas. Les patients présentant une EP sous-segmentaire ont montré des taux de survie significativement plus élevés à la fois à 30 jours et à la fin du suivi (Fig. 1). Aucune différence n’a été observée dans la cause du décès en fonction de l’étendue de l’EP (Fig. 2). Les facteurs indépendamment liés à une probabilité plus élevée de mortalité étaient le diagnostic de cancer et une comorbidité plus élevée mesurée par l’indice de Charlson (tableau 3).
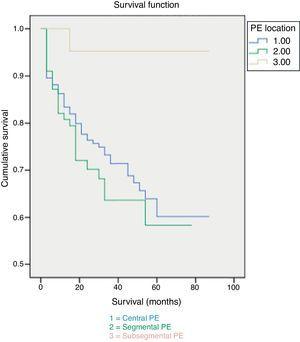
Taux de survie global et extension de l’EP.

Causes de décès et extension de l’EP.
Prédicteurs de mortalité. Analyse multivariée.
| Facteurs | OR | CI 95% |
|---|---|---|
| PE localisation | ||
| Centrale | 1 | |
| Segmentaire | 1.28 | 0,79-2,09 |
| Sous-segmentaire | 0,29 | 0,03-2.23 |
| Cancer | ||
| Non | 1 | |
| Oui | 3.72 | 2.30-6.03 |
| Charlson | ||
| 0 | 1 | |
| 1-2 | 2.81 | 0.82-9.59 |
| ≥3 | 8.61 | 2.58-28,69 |
Ajusté en fonction de l’âge, du sexe, de la fonction rénale et des paramètres des gaz du sang.
Discussion
La prévalence de l’EP sous-segmentaire était de 7%, similaire à celle rapportée par d’autres auteurs5. Aucune différence significative entre les sexes n’a été trouvée en termes d’étendue de la maladie ; cependant, la proportion de femmes est légèrement plus élevée dans notre échantillon. L’âge des patients présentant une EP sous-segmentaire était inférieur à celui des patients présentant une EP centrale et segmentaire. Cette différence pourrait être liée à l’hypercoagulation et aux modifications de l’endothélium vasculaire qui viennent avec le vieillissement19 : celles-ci pourraient faciliter l’étendue des thrombi chez les patients plus âgés, surtout si l’on considère qu’aucune différence d’âge n’a été trouvée dans la prévalence des facteurs de risque de l’EP.
Bien que les symptômes de l’EP ne soient pas spécifiques et que la présentation soit généralement similaire chez les adultes, nous avons trouvé des douleurs thoraciques chez les patients plus jeunes et une association positive entre l’âge et la dyspnée19. Dans notre étude, la douleur thoracique chez les patients plus jeunes présentant une EP périphérique et la dyspnée chez les patients plus âgés présentant une EP centrale et des niveaux d’hypoxie plus élevés ont été le plus souvent rapportées. En général, la dyspnée était moins fréquente chez les patients atteints d’une EP sous-segmentaire.10 Ces derniers ont obtenu de meilleurs résultats lors de l’analyse des gaz du sang et présentaient une présentation clinique globalement moins sévère,20 y compris une TVP proximale plus faible.5,10
Les taux de D-dimères chez les patients atteints d’EP semblent être associés à la taille du thrombus, sont liés à la sévérité de l’EP et ont une valeur en tant que marqueur pronostique.21 Nous avons trouvé des taux sériques plus faibles chez les patients atteints d’une EP sous-segmentaire, qui présentaient une présentation clinique plus bénigne et un meilleur résultat à moyen terme. Cependant, le test des D-dimères n’a été effectué que dans 30 % des cas. Nos résultats ne sont donc pas concluants.
Dans notre étude, la mortalité à 30 jours était plus élevée que dans d’autres études,22 bien que la proportion de décès liés à l’EP soit similaire.4 Aucun des patients n’est décédé à la suite d’une EP sous-segmentaire. Les différences de mortalité pourraient être dues à différentes causes : l’âge moyen de nos patients est plus élevé, beaucoup d’entre eux ont des maladies chroniques concomitantes qui peuvent conditionner la mauvaise issue de l’EP, et le nombre de décès dus à une comorbidité est également élevé. En fait, le facteur déterminant le plus important de la mortalité est la comorbidité, en particulier le cancer. Les patients atteints d’un cancer et d’une EP ont non seulement un mauvais pronostic, mais aussi un pronostic plus défavorable que les patients atteints uniquement d’un cancer ou d’une EP.23 Les symptômes de l’EP peuvent être confondus avec ceux d’exacerbations de maladies cardio-pulmonaires antérieures,24 ce qui retarde le diagnostic et le traitement, aggrave le pronostic et augmente la mortalité. Les patients plus âgés sont plus complexes et peuvent présenter une comorbidité plus élevée et un retard de diagnostic24 ; la comorbidité a également été suggérée comme un facteur de risque d’EP chez ces patients.25,26
La signification clinique de l’EP sous-segmentaire est inconnue. Cependant, elle peut avoir une pertinence clinique et des conséquences à long terme chez les patients ayant une faible réserve cardiopulmonaire.2 Elle présente généralement une faible mortalité2,27 et un bon pronostic.5,28 Ainsi, un certain nombre d’auteurs ont suggéré que certains patients ne nécessiteraient pas de traitement anticoagulant.29,30
Nos données suggèrent que les patients présentant une EP sous-segmentaire diffèrent cliniquement dans une large mesure de ceux présentant une EP plus proximale. Le pronostic est influencé par la présence de troubles d’accompagnement plutôt que par l’étendue de la maladie.
Divulgations éthiquesProtection des sujets humains et animaux
Les auteurs déclarent que les procédures suivies étaient conformes aux règlements du comité d’éthique de la recherche clinique concerné et à ceux du Code d’éthique de l’Association médicale mondiale (Déclaration d’Helsinki).
Confidentialité des données
Les auteurs déclarent avoir suivi les protocoles de leur centre de travail sur la publication des données des patients et que tous les patients inclus dans l’étude ont reçu des informations suffisantes et ont donné leur consentement éclairé écrit pour participer à l’étude.
Droit à la vie privée et au consentement éclairé.
Laisser un commentaire