Ben Valsler
Tout ce qui brille n’est pas de l’or,
vous l’avez souvent entendu dire.
Brian Clegg montre une autre facette,
de l’or des fous – le sulfure de fer.
Brian Clegg
‘Il y a de l’or dans ces collines! » Ou bien y en a-t-il ? Comme son surnom d’or des fous le suggère, la forme minérale pyrite du disulfure de fer II a plus qu’une ressemblance passagère avec le métal précieux. Avec la formule simple FeS2, la structure cubique du composé peut donner lieu à la production de formes platoniques d’aspect remarquablement efficace, à la fois en cubes aux bords nets et en dodécaèdres qui semblent avoir été fabriqués, bien que plus souvent la formation naturelle donne lieu à une structure moins clairement démarquée.

Source : ©
Dans les cristaux de disulfure de fer, les atomes de soufre viennent par paires, l’une des quatre liaisons du soufre étant liée à un autre atome de soufre. Ces liaisons sont rompues par chauffage pour produire du sulfure de fer II – FeS – et du soufre. Ce processus est utilisé dans la production de dioxyde de soufre, à la fois pour utiliser le gaz, par exemple comme agent de blanchiment pour le papier, et comme première étape de la production d’acide sulfurique. Plus récemment, le composé, qui est un semi-conducteur, a trouvé une utilisation dans les batteries lithium-fer, où la cathode est constituée de disulfure de fer : ces batteries sont compatibles en tension avec les piles traditionnelles de 1,5 volt, mais durent beaucoup plus longtemps que les équivalents alcalins.

Source : ©
La première application du disulfure de fer a peut-être été de remplacer le silex pour faire des étincelles – d’où le nom de pyrite – et a souvent été utilisé de cette manière dans les premiers pistolets. Il a également été utilisé pendant longtemps dans la production de sulfate de fer, traditionnellement connu sous le nom de vitriol vert. Le disulfure de fer est encore parfois utilisé de cette manière, bien qu’avec des mécanismes plus sophistiqués que l’approche traditionnelle consistant à laisser un tas de pyrite sous la pluie et à recueillir le liquide qui s’en écoule.
En s’oxydant, le minéral dégage une assez grande quantité de chaleur, ce qui peut entraîner des explosions dans les mines de charbon à forte teneur en soufre. Cette tendance à l’oxydation ne signifie pas pour autant que le disulfure de fer II est toujours enfermé. La pyrite polie est utilisée en joaillerie depuis l’Antiquité et ses cristaux plutôt sombres (ils ont rarement l’éclat de l’or) étaient particulièrement à la mode entre la fin des années 1700 et le début du XXe siècle.

Source : ©
Broche en marcassite
Parfois, les bijoux en pyrite sont appelés bijoux en marcassite – ce qui prête à confusion car il existe un autre minéral disulfure de fer II appelé marcassite, où la structure cubique est étirée vers ce que l’on appelle une forme orthorhombique. Cette forme est moins adaptée à la fabrication de pierres précieuses car elle est plus fragile et susceptible de s’effriter. Le nom du bijou (souvent prononcé « marca-seet » au Royaume-Uni) remonte à une époque où toutes les formes du minéral étaient connues sous le nom de marcassite.

Source : ©
Marcasite minérale
Cependant, le disulfure de fer II n’est en aucun cas la seule façon de combiner le fer et le soufre. Le sulfure de fer II, d’apparence beaucoup moins attrayante, est une substance tachetée de noir dont la structure est octaédrique autour du fer. Ce composé se forme assez fréquemment à partir de la décomposition de matières organiques, que ce soit sous forme de boue noire dans les marécages ou de décoloration sombre d’un jaune d’œuf trop cuit.
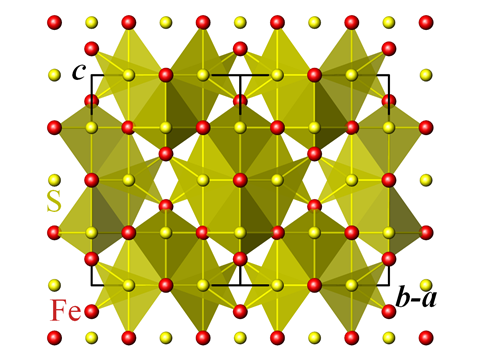
Source : Perditax
Structure cristalline de la greigite
Ce n’est que le début pour les variantes subtiles du sulfure de fer. Des minéraux connus sous le nom de greigite, mackinawite et pyrrhotite présentent des variantes de la structure, tandis que la poudre noire de sulfure de fer III – Fe2S3 – n’a jamais été produite qu’artificiellement. La greigite fait partie des capacités d’un groupe de bactéries marines découvertes en 1975 seulement, qui ont la remarquable capacité de s’orienter en fonction du champ magnétique terrestre. Appelés bactéries « magnétotactiques », ces organismes ont dans leurs cellules des cristaux qui sont principalement de la greigite, qui est l’équivalent en sulfure de fer du matériau magnétique naturel le plus connu, l’oxyde de fer magnétite.

Source : Raymond T. Downward, NASA
Surface gravée de la météorite Mundrabilla, montrant une phase métallique d’alliage fer-nickel de kamcite (38% Ni) et de taenite (6% Ni) en bas à droite, en bas à gauche et en haut à gauche. Le matériau plus sombre est un sulfure de fer (FeS ou troilite) avec un précipité parallèle de duabreelite (sulfure de fer et de chrome (FeCr2S4).
Peut-être que la plus intéressante des structures alternatives est la troilite, une autre forme de sulfure de fer avec une structure hexagonale. Bien qu’on en trouve occasionnellement à l’état natif sur Terre, on la retrouve le plus souvent dans les météorites – plus précisément dans les variétés relativement peu communes qui ont pris naissance sur la Lune et sur Mars avant d’être expulsées de la surface lors d’un impact venu de l’espace.

Le nom troilite a été donné en l’honneur du prêtre italien Domenico Troili qui a fait la première observation enregistrée d’une météorite entraînant un objet frappant le sol en 1766. Troili pensait que le matériau principal de la météorite était la marcassite (ce qui signifie probablement la pyrite), mais près de 100 ans plus tard, le minéralogiste allemand Gustav Rose a identifié la composition de la météorite comme étant un sulfure de fer différent et l’a nommé d’après Troili.
Le sulfure de fer peut être une douleur. Il peut s’accumuler, par exemple, dans les puits de pétrole et de gaz, et boucher les tubulures. Cependant, ailleurs, il a prouvé sa valeur. C’est peut-être un simple composé de deux éléments chimiques simples, et comme la pyrite un faux or trompeur, mais dans ses formes variées, il montre une diversité et une adaptabilité qui font de ses utilisateurs tout sauf des imbéciles.
Ben Valsler
C’était Brian Clegg en défense du sulfure de fer. La semaine prochaine, Mike Freemantle avec le kérosène et une forme de guerre non conventionnelle.
Michael Freemantle
Un mois environ après l’attaque japonaise sur Pearl Harbor en décembre 1941, un dentiste américain a eu l’idée de démolir les villes japonaises en attachant de minuscules bombes incendiaires à des chauves-souris.
Ben Valsler
Découvrez la prochaine fois ce qui s’est passé dans Project x-ray. D’ici là, vous pouvez envoyer un courriel à [email protected] ou tweeter @chemistryworld si vous avez des demandes de composés que nous devrions inclure dans le podcast. Je suis Ben Valsler, merci de m’avoir rejoint.
Laisser un commentaire