Dans un premier temps, une introduction générale des maladies du tilapia a été présentée dans le bulletin 11, suivie d’un article sur la streptococcose (bulletin 12) et d’un aperçu de la maladie de Columnaris (bulletin 13). La sévérité des infections parasitaires chez le tilapia augmente avec l’intensification des systèmes de culture. Par conséquent, le présent article sera axé sur les maladies parasitaires du tilapia et les mesures de contrôle possibles.
Dépistage des parasites et étiologie des principaux parasites affectant le tilapia
Comprendre l’étiologie d’une maladie parasitaire est d’une importance cruciale car elle détermine le choix d’un traitement potentiel.

Contrairement aux maladies bactériennes ou virales pour lesquelles il est nécessaire d’identifier le micro-organisme au niveau de l’espèce avant de mettre en place une stratégie de vaccination adaptée, l’identification des parasites au niveau du genre est généralement suffisante pour mettre en place une stratégie thérapeutique ou prophylactique efficace. Par conséquent, les seuls éléments nécessaires à un diagnostic parasitaire efficace au niveau de l’élevage sont un microscope optique et une connaissance de base de la taxonomie, de la taille et de la morphologie des parasites.

Le diagnostic parasitaire doit commencer par une observation macroscopique externe des poissons afin de vérifier la présence de parasites plus gros tels que les sangsues et les copépodes crustacés. En outre, une infestation par un trématode digénien peut être suspectée lorsque des vers jaunes ou blancs sont observés sur la peau. Ensuite, le dépistage des parasites doit être poursuivi par l’observation d’un raclage de la peau et des branchies au microscope optique à des grossissements de X40 et X100. A ces grossissements, on peut observer la forme et les mouvements typiques des ciliés protozoaires tels que Trichodina et Ichthyophthirius multifiliis, la présence de trophontes Amyloodinium inertes et opaques, ou la présence de parasites monogéniques. De même, la présence de métacercaires de trématodes digéniques peut être mise en évidence chez un ver de peau par l’observation d’un frottis frais en microscopie optique.
Une fois l’identité du parasite déterminée, la gravité d’une infestation parasitaire est évaluée par le nombre de parasites affectant chaque poisson. En général, la présence d’un seul ou d’un petit nombre de parasites individuels par poisson n’est pas un facteur alarmant. Cependant, la présence d’un nombre massif de parasites sur chaque poisson pourrait constituer une réelle menace pour la population de poissons et devrait nécessiter une action immédiate.
Par conséquent, le dépistage systématique des parasites est une partie importante d’une bonne gestion de la santé et devrait être fait régulièrement pour permettre une action rapide si nécessaire. Les parasites affectant le tilapia peuvent être classés en plusieurs groupes principaux : ciliés protozoaires, dinoflagellés, trématodes monogéniques et digéniques, copépodes crustacés et hirudidés. Le tableau suivant présente une brève description de certains des parasites les plus graves chez le tilapia.
|
Illustration des principaux parasites du Tilapia, signes cliniques associés, épidémiologie et traitements possibles
|
||||
| PARASITE | Signes cliniques | Épidémiologie / facteurs de risque | Traitements possibles | |
|---|---|---|---|---|
| Ciliés | Trichodina spp. (Trichodina en montage humide branchial) |
Nage erratique Opercule ouvert Raclage contre les parois Saut hors de l’eau Erosion des nageoires, ulcères cutanés Hyperplasie des branchies | Mortalité massive en phases d’éclosion et de nurserie | Bain de sel Bain de formol Bain de Hsup2 ;O² bain KMnO4 bain |
Ichthyophthirius multifilis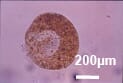 (Ich sur peau mouillée) |
Apparition de taches blanches sur la peau Mucus épais sur la peau Retard de croissance et mortalité | Plus grave aux stades larvaires Problème dans le système de recirculation | Bain de formol répété Augmentation de la salinité | |
| Dinoflagellés | Amyloodinium spp. (Trophont dans le filament branchial) |
Diminution de l’appétit Flashing Accumulation de mucus | Eau saumâtre 10-.15 ppt Ne se produit pas en eau douce | H2O&2bain |
| Trématodes | Digenena (Clinostomum spp) Métacercaires provenant du montage humide du muscle) |
Groutons (jaunes ou blancs) sur la peau. Hémorragie cutanée et mort si pénétration massive du parasite | Survient dans les élevages en étang en présence d’escargots et d’oiseaux | Remplacer ou éradiquer les escargots de l’étang Empêcher l’accès des oiseaux à l’élevage |
Dactyolgyrus monogène. spp (Adulte sur peau montage humide) |
Fombrage de la peau Érosion des nageoires Excès de mucus Mouvement rapide de l’opercule Émaciation chez les jeunes poissons | Stades juvénile et alevin | Bain de formol Bain H2O2 | |
Argulus sp. (adulte de la peau de poisson) |
Irritation cutanée Perte d’état Infection bactérienne cutanée secondaire associée | Sévère aux stades larvaires et aux alevins | Organophosphates | |
| Crustacés Copépodes | Lernea spp.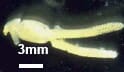 (adulte sur la peau du poisson) |
Frotter contre les parois du récipient Taches blanchâtres de vers enroulés incrustés dans la peau | Peut affecter la reproduction buccale | Organophosphates |
| Hirudidae | Sangsues (adultes sur la peau du poisson) |
Forte nombre de sangsues sur un poisson adulte induit une anémie | Sévère aux premiers stades Affecte les poissons déjà affaiblis par une autre maladie | Organophosphates |
Epidémiologie et facteurs de risque des maladies parasitaires chez le tilapia
Les parasites font partie de l’environnement normal. Il existe plusieurs facteurs qui influencent la prévalence et la gravité d’une maladie parasitaire. Ces facteurs sont des facteurs biologiques directement liés au tilapia et des facteurs environnementaux liés au plan d’eau et au système d’élevage.
Facteurs biologiques :
- Age : Ce qui est vrai pour les poissons en général l’est aussi pour le tilapia en particulier : Les jeunes poissons sont plus sensibles que les adultes. Par exemple, les tilapias nouvellement éclos et juvéniles sont extrêmement sensibles aux parasites protozoaires. Une attention particulière au dépistage des parasites est nécessaire à ces stades pour assurer une survie maximale.
- Stress : Les pratiques d’élevage telles que la surpopulation et les changements environnementaux dans la qualité de l’eau peuvent compromettre le système immunitaire du tilapia et le rendre plus sensible aux infestations parasitaires. Le nombre de parasites augmente invariablement sur les poissons affaiblis. Les infestations parasitaires peuvent rendre la population de poissons plus vulnérable aux infections bactériennes ou virales secondaires, directement par le biais de lésions cutanées ou en induisant une fatigue physiologique ou une immunosuppression. Vice-versa, il est fréquent d’observer des parasites chez des poissons principalement infectés par une maladie bactérienne telle que la streptococcose.
- Nutrition : Si le régime alimentaire est inadéquat, le système immunitaire du poisson peut être déprimé et ne tolérera pas de fortes charges parasitaires. La première alimentation et les régimes des premiers stades sont particulièrement importants pour aider le poisson à survivre aux infestations parasitaires.
- Hautes densités de peuplement : Les fortes densités de stockage provoquent un stress et facilitent la transmission des parasites. La transmission directe de poisson à poisson est utilisée par les ciliés protozoaires et les trématodes monogéniques. Il est beaucoup plus facile pour le parasite de trouver un hôte dans les populations à haute densité et cela permet également au parasite de se reproduire plus rapidement et plus efficacement.
Facteurs environnementaux:
- Salinité : Comme certains parasites ne survivent que dans les eaux saumâtres et que d’autres ne tolèrent que l’eau douce, la salinité est un facteur important influençant l’infestation par un parasite spécifique. Par exemple, les dinoflagellés tels que Amyloodinium spp. ne peuvent survivre que dans les eaux saumâtres et marines, ce parasite n’est donc pas présent en eau douce. En revanche, certaines espèces de Trichodina ne peuvent tolérer que l’eau douce et meurent avec aussi peu que 5ppt de sel dans l’eau.
- Qualité de l’eau : Les paramètres de mauvaise qualité de l’eau tels que les matières organiques élevées, l’ammoniac élevé, l’oxygène dissous faible et la charge bactérienne élevée peuvent créer un environnement sous-optimal qui peut être stressant pour les poissons et conduire à une incidence plus élevée des épidémies parasitaires.
- Système de culture : Chaque système de culture a ses propres caractéristiques. Par exemple, les réservoirs ou les cages, qui contiennent de fortes densités de poissons, sont un bon environnement pour la transmission d’ectoparasites à cycle de vie direct comme les trématodes monogéniques. Les étangs en terre constituent un environnement plus complexe avec de la végétation où des parasites comme les copépodes crustacés ou les sangsues peuvent pondre. La boue peut être un réservoir pour les kystes de dinoflagellés comme Amyloodinium ou d’invertébrés agissant comme hôtes intermédiaires comme les escargots pour les trématodes digéniques. Plus l’étang est grand, plus il est difficile de contrôler la population de parasites car il est plus ouvert aux prédateurs des poissons qui peuvent semer des œufs et d’autres stades parasitaires. Les systèmes de recirculation ont leur propre lot de problèmes relatifs au parasitisme : en raison de l’accumulation de sédiments, du lent retournement de l’eau, les systèmes de recirculation favorisent également la croissance et la concentration des parasites. Par conséquent, une vigilance particulière est nécessaire lors de l’introduction de poissons ou d’œufs de poissons dans ces systèmes.
Mesures préventives et traitement possible des maladies parasitaires du tilapia

On dit souvent qu’il vaut mieux prévenir que guérir pour les maladies virales et bactériennes. Ce dicton est également vrai lorsqu’il s’agit de parasites. Comme ces organismes font partie de l’environnement normal des poissons, il est impossible de les éviter et nous devons apprendre à vivre avec eux. La nature des parasites peut varier selon les systèmes d’élevage et les pays. Par conséquent, le dépistage systématique des parasites sur les poissons sains et malades est un élément majeur de la stratégie de prévention afin de comprendre quels sont les parasites à surveiller dans un élevage donné.
En effet, la réalisation d’enquêtes hebdomadaires sur une année entière devrait donner un aperçu complet de la faune parasitaire présente dans l’élevage et mettre en évidence les variations d’incidence et de prévalence dues à la saisonnalité, à la salinité et à la température. Une fois la faune parasitaire clairement identifiée, il est important d’adapter certaines pratiques agricoles en fonction de la biologie des parasites présents dans l’exploitation. Par exemple, il est courant pour les écloseries de tilapias de maintenir la salinité de l’eau entre 5 et 10 ppt afin de contrôler la population de ciliés protozoaires tels que Trichodina. Dans les systèmes extensifs d’étangs en terre, le contrôle biologique des escargots et des oiseaux est la stratégie la plus efficace pour briser le cycle des trématodes digéniques et éviter leur présence dans les étangs.
Dépendamment de la nature des parasites présents dans l’élevage et des produits chimiques légalement autorisés dans le pays d’élevage, il existe plusieurs produits chimiques potentiels qui peuvent être appliqués par bain, comme le sel, le formol, H2O2 et KMnO4. Cependant, la dose et la durée du traitement doivent être adaptées à plusieurs paramètres :
- L’âge et l’état physiologique du poisson : Les juvéniles sont plus sensibles que les adultes au traitement chimique et ne peuvent pas tolérer une concentration similaire de produit chimique.
- La disponibilité d’oxygène pur ou d’aération pendant le traitement : Pendant certains des traitements chimiques, comme le bain de formol, la concentration d’oxygène dissous présent dans l’eau est réduite. Par conséquent, il est nécessaire de compenser cela par une oxygénation artificielle de l’eau.
- Le type de système de culture : Un traitement très concentré peut être mis en œuvre en utilisant un système de bâche sur une cage mais cela devient peu pratique et non économique lorsqu’il est appliqué à un grand plan d’eau tel qu’un étang. Dans de tels systèmes, des doses plus faibles de produit chimique pour une durée d’immersion plus longue doivent être testées.

Donc, chaque traitement doit être évalué à petite échelle pour sa sécurité et son efficacité avant d’être mis en œuvre au niveau de l’exploitation. En outre, il faut se rappeler que l’application de tout traitement chimique peut avoir des effets secondaires indésirables. Par exemple, l’eau salée est un traitement efficace contre les ciliés protozoaires ; cependant, le pompage de l’eau de mer sans filtration dans la ferme peut entraîner l’introduction concomitante d’agents pathogènes bactériens indésirables. De plus, le formol, un autre traitement chimique possible pour les ciliés protozoaires, doit être appliqué avec précaution dans les étangs car il pourrait induire des mortalités de plancton.
Enfin, des mesures simples de gestion sanitaire devraient être mises en œuvre autant que possible pour réduire l’introduction et la propagation des parasites au niveau de l’élevage. En effet, avant l’introduction de nouveaux poissons dans un élevage ou lors du transfert d’une unité à une autre, les poissons devraient recevoir un traitement parasitaire prophylactique. De plus, le matériel d’élevage devrait être séparé entre les différentes unités de l’élevage pour éviter la propagation horizontale des parasites. Après chaque cycle, les systèmes de détention des poissons doivent être correctement nettoyés et désinfectés afin de limiter l’accumulation de parasites d’un cycle à l’autre. En définitive, les poissons stressés étant plus sensibles aux parasites, la règle d’or de tout éleveur devrait être de maintenir le niveau de stress le plus bas possible, notamment pendant et après tout événement ou procédure qui provoque un stress, comme le transport, la manipulation, un changement de saisonnalité et/ou un changement de qualité de l’eau.
Juin 2007
Laisser un commentaire