From Proteopedia
proteopedia linkproteopedia link
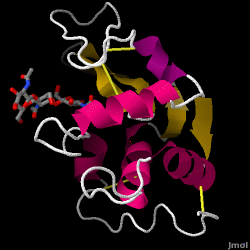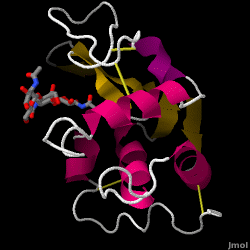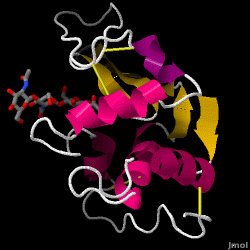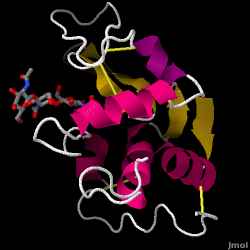
Le lysozyme – également connu sous le nom de muramidase – est une enzyme puissante que l’on trouve en abondance dans les larmes, la salive et le lait humain. Chez l’homme, elle est codée dans le gène LYZ. Comme il s’agit d’une petite protéine, facilement disponible et très stable, elle a fait l’objet de recherches approfondies concernant sa fonction et sa structure.
Introduction
Le lysozyme agit comme une défense non spécifique contre les bactéries et les champignons. C’est un composant du système immunitaire inné, et c’est un élément important de l’alimentation du nourrisson pour éviter la diarrhée. Il s’agit d’une enzyme connue pour sa capacité à dégrader l’architecture polysaccharidique de nombreux types de parois cellulaires, normalement dans le but de se protéger contre les infections bactériennes. La structure du lysozyme de blanc d’œuf de poule (HEW), qui fait l’objet de cet article, est illustrée à droite. L’activité antibactérienne du blanc d’œuf de poule a été décrite pour la première fois par Laschtschenko en 1909. Elle a été caractérisée et nommée « lysozyme » par Alexander Fleming, la même personne à qui l’on doit la découverte de la pénicilline. La découverte de l’activité enzymatique a été accidentelle : au cours d’une expérience sans rapport avec le sujet, des gouttes nasales ont été introduites par inadvertance dans une boîte de Pétri contenant une culture bactérienne, laquelle culture présentait alors les résultats d’une réaction enzymatique encore inconnue. L’observation de cette réaction inconnue a conduit à d’autres recherches sur les composants de cette réaction ainsi qu’à l’identification correspondante du nouveau « lysozyme ». En 1965, David C. Phillips et ses collègues ont déterminé la structure tridimensionnelle du lysozyme à une résolution de 2 Å. Le travail de Phillips était particulièrement révolutionnaire car il avait réussi à élucider la structure d’une enzyme par cristallographie aux rayons X – un exploit qui n’avait jamais été accompli auparavant. Les recherches de Phillips ont également conduit à une hypothèse basée sur la structure de son mécanisme d’action.
Fonction
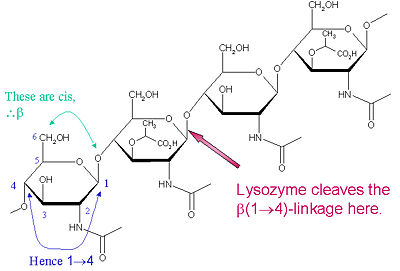
Le substrat particulier de préférence pour ce type de clivage est un (NAG-NAM)₃ hexasaccharide, au sein duquel substrat se produit la liaison glycosidique cible de clivage, NAM₄-β-O-NAG₅. Les unités de liaison hexasaccharidiques individuelles sont désignées A-F, la préférence de clivage de la liaison glycosidique NAM₄-β-O-NAG₅ correspondant à une unité D-E de liaison glycosidique cl
Lysozyme est connu pour endommager les parois cellulaires bactériennes en catalysant l’hydrolyse des liaisons 1,4-bêta-liaisons entre les résidus d’acide N-acétylmuramique (NAM) et de N-acétyl-D-glucosamine (NAG) dans le peptidoglycane, et entre les résidus de N-acétyl-D-glucosamine dans les chitodextrines. De cette façon, le lysozyme est efficace pour lyser les parois cellulaires des bactéries et des champignons. Le lieu de clivage pour le lysozyme sur ce thème architectural est la liaison β(1-4) glycosidique reliant le carbone C1 du NAM au carbone C4 du NAG.
Le substrat particulier de préférence pour ce type de clivage est un hexasaccharide (NAG-NAM)₃, au sein duquel substrat se produit la liaison glycosidique cible de clivage, NAM₄-β-O-NAG₅. Les unités de liaison hexasaccharidiques individuelles sont désignées par les lettres A-F, la préférence de clivage de la liaison glycosidique NAM₄-β-O-NAG₅ correspondant à une préférence de clivage de la liaison glycosidique de l’unité D-E. Selon l’organisme à partir duquel le lysozyme est obtenu, l’hydrolyse de la liaison glycosidique se déroule avec conservation de la configuration au niveau du carbone anomérique (blanc d’œuf de poule) ou avec inversion (oie, phage T4).
Le lysozyme agit efficacement sur les longs polymères (NAG-NAM) ou (NAG). Lorsque la longueur de la chaîne devient inférieure à six monomères, les taux catalytiques chutent considérablement ; en fait, les trisaccharides agissent comme des inhibiteurs compétitifs en se liant au site actif dans un registre non productif.
Lyssozyme de blanc d’oeuf de poule (code PDB 1hew)
Mécanisme
L’hydrolyse des liaisons glycosidiques par le lysozyme de blanc d’œuf de poule se déroule avec conservation de la configuration. En 1953, Koshland a suggéré qu’en général, la rétention de configuration implique un mécanisme à double déplacement (alors que l’inversion de configuration implique un déplacement simple). Pendant des décennies, deux hypothèses mécanistes concurrentes (Phillips : mécanisme dissociatif avec un intermédiaire oxocarbénium ; Koshland : mécanisme associatif en deux étapes avec un complexe enzymatique covalent comme intermédiaire) ont été envisagées, les données de 2001 faisant pencher la balance vers l’existence d’un intermédiaire covalent. L’absence d’une structure complexe de substrat a certainement contribué aux difficultés de distinction entre les mécanismes possibles, tout comme l’existence de deux mécanismes distincts (rétention et inversion de configuration) au sein de la même famille structurelle d’enzymes (par ex. enzyme de poule vs enzyme d’oie).
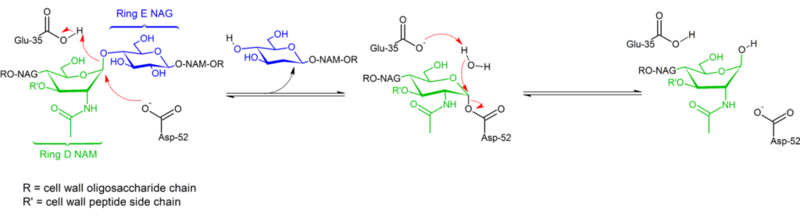
Le lysozyme hydrolyse un glycoside (d’où la classification familiale du lysozyme comme glycosylase), ce qui correspond à la conversion d’un acétal en hémiacétal. La réaction se déroule en deux étapes comme le montre la figure ci-dessus. Dans la première étape, l’Asp 52 agit comme nucléophile et une partie du sucre est le groupe partant. Dans la seconde étape, l’eau agit comme nucléophile et l’Asp 52 comme groupe partant. Les deux étapes inversent la configuration au niveau du carbone anomérique, ce qui entraîne une conservation globale de la configuration. Glu 35 agit comme un acide dans la première étape (en protonant le sucre de la liaison glycosidique pour en faire un meilleur électrophile) et comme une base dans la deuxième étape (en déprotonant l’eau pour en faire un meilleur nucléophile). Alors que la figure montre certains des sucres dans une conformation de bateau pour souligner l’inversion de configuration, ceux-ci ne sont pas observés expérimentalement mais se trouvent plutôt dans une conformation de chaise.
Applications du lysozyme
Depuis que le lysozyme a été largement reconnu pour ses propriétés antibactériennes et antifongiques, il a une grande variété d’utilisations à la fois dans les applications biochimiques et pharmaceutiques. En biologie moléculaire, le lysozyme est souvent utilisé dans la procédure de lyse alcaline pour extraire et isoler l’ADN plasmidique. Il est largement utilisé dans le domaine pharmaceutique pour détruire les bactéries gram-positives, et peut être utilisé pour soutenir les défenses immunitaires déjà existantes pour combattre les infections bactériennes. Cette enzyme est particulièrement importante pour prévenir les maladies bactériennes chez les nourrissons. En raison de ses propriétés antibactériennes, le lysozyme peut également être utilisé dans l’industrie alimentaire pour aider à prévenir la détérioration des aliments.
Voir aussi
- Structures 3D du lysozyme
- Lysozyme
- Glycoside hydrolases de rétention
- Terrain de jeu moléculaire/Lysozyme
- Utilisateur :Judy Voet/Lysozyme
- Lysozyme (arabe)
- Lysozyme (hébreu)
- Ragland SA, Criss AK. De la destruction bactérienne à la modulation immunitaire : Aperçus récents sur les fonctions du lysozyme. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi : 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) Sur un élément bactériolytique remarquable trouvé dans les tissus et les sécrétions. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure du lysozyme du blanc d’œuf de poule. Une synthèse de Fourier tridimensionnelle à une résolution de 2 angströms. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. Une introduction à la chimie des enzymes et des coenzymes. Blackwell Science Ltd, Oxford
- Solutions les plus anciennes pour les structures cristallines macromoléculaires.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Études cristallographiques de l’activité du lysozyme du blanc d’œuf de poule. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi :, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Image de : http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Les premiers dessins en ruban des protéines. Nat Struct Biol. 2000 Aug;7(8):624-5. doi : 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure du lysozyme du blanc d’œuf de poule. Une synthèse de Fourier tridimensionnelle à une résolution de 2 angströms. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Structure de certains complexes lysozyme-inhibiteur cristallins déterminés par analyse aux rayons X à une résolution de 6 Angstroms. Nature. 22 mai 1965;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14,0 14,1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. La catalyse par le lysozyme du blanc d’œuf de poule procède par un intermédiaire covalent. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers et Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Page Proteopedia Contributeurs et rédacteurs (qu’est-ce que c’est ?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
.
Laisser un commentaire