La combustion des hydrocarbures désigne la réaction chimique où un hydrocarbure réagit avec l’oxygène pour créer du dioxyde de carbone, de l’eau et de la chaleur. Les hydrocarbures sont des molécules composées à la fois d’hydrogène et de carbone. Ils sont surtout connus pour être le principal constituant des combustibles fossiles, à savoir le gaz naturel, le pétrole et le charbon. Pour cette raison, les ressources en combustibles fossiles sont souvent appelées ressources en hydrocarbures. L’énergie est obtenue à partir des combustibles fossiles par la combustion du combustible. Bien qu’il existe des impuretés dans les combustibles fossiles, la combustion des hydrocarbures est le principal processus de combustion des combustibles fossiles. Un exemple de combustion d’hydrocarbures est illustré à la figure 1. Voir la simulation en bas de page pour d’autres exemples.
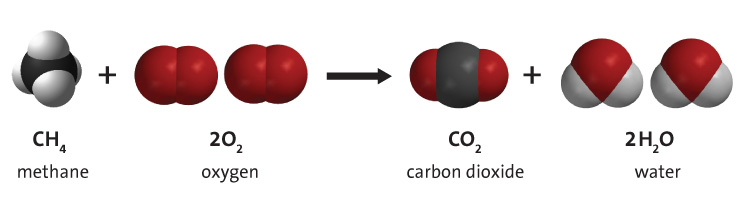
Description
Quel que soit le type d’hydrocarbure, la combustion avec l’oxygène donne 3 produits : du dioxyde de carbone, de l’eau et de la chaleur, comme le montre la réaction générale ci-dessous. L’énergie nécessaire à la rupture des liaisons des molécules d’hydrocarbures est nettement inférieure à l’énergie libérée lors de la formation des liaisons des molécules de CO2 et de H2O. Pour cette raison, le processus libère des quantités importantes d’énergie thermique (chaleur). Cette énergie thermique peut être utilisée directement (par exemple pour chauffer une maison) ou être convertie en énergie mécanique à l’aide d’un moteur thermique. Cependant, cette dernière est sujette à des pertes d’efficacité, ce qui entraîne des pertes d’énergie importantes nécessaires (sous forme de chaleur perdue) régies par la deuxième loi de la thermodynamique. L’énergie mécanique utile résultante sera beaucoup moins importante que l’énergie thermique initiale fournie par la combustion des hydrocarbures.
Équation générale de la réaction :
- désigne le nombre d’atomes de carbone dans l’hydrocarbure
- désigne le nombre d’atomes d’hydrogène dans l’hydrocarbure
- désigne le nombre d’atomes d’oxygène nécessaires à la réaction de combustion des hydrocarbures
Combustion des hydrocarbures et combustibles fossiles
Notez que du CO2 est toujours produit lors de la combustion des hydrocarbures ; peu importe le type de molécule d’hydrocarbure. La production de CO2 et de H2O est en fait la façon dont l’énergie utile est obtenue à partir des combustibles fossiles. C’est pourquoi il est important de faire la distinction entre le dioxyde de carbone et les autres « déchets » qui proviennent des impuretés présentes dans le combustible, comme les composés de soufre et d’azote. Les déchets qui proviennent des impuretés peuvent être éliminés avec la bonne technologie ; le CO2 ne peut pas être éliminé à moins que les combustibles fossiles ne soient pas brûlés (utilisés) en premier lieu.
Tous les combustibles fossiles n’ont pas la même composition. Le gaz naturel est composé à plus de 90% de méthane (CH4) qui est la plus petite molécule d’hydrocarbure. Le pétrole a tendance à être composé de molécules de taille moyenne, bien que la composition varie beaucoup d’une catégorie de brut à l’autre. En général, plus le pétrole est dense, plus les chaînes de carbone des molécules sont longues. Enfin le charbon contient les molécules d’hydrocarbures les plus grandes et les plus complexes.
Puisque les différents hydrocarbures ont des rapports différents entre l’hydrogène et le carbone, ils produisent des rapports différents entre l’eau et le dioxyde de carbone. En général, plus la molécule est longue et complexe, plus le rapport entre le carbone et l’hydrogène est élevé. C’est pourquoi la combustion de quantités égales de différents hydrocarbures produira des quantités différentes de dioxyde de carbone, en fonction du rapport entre le carbone et l’hydrogène dans les molécules de chacun. Étant donné que le charbon contient les molécules d’hydrocarbures les plus longues et les plus complexes, sa combustion dégage plus de CO2 que la combustion d’une même masse de pétrole ou de gaz naturel. Cela modifie également la densité énergétique de chacun de ces combustibles.
Émissions de dioxyde de carbone
Vous trouverez ci-dessous un tableau du CO2 émis par la production de 293,1 kWh (1 000 000 BTU) d’énergie à partir de divers combustibles hydrocarbonés.
| Combustible | kg d’émissions de CO2 |
|---|---|
| Charbon anthracite | 104 |
| Charbon bitumineux | 93.5 |
| Charbon lignite | 97,9 |
| Charbon subbitumineux | 97,4 |
| Diesel | 73.2 |
| Essence | 71,5 |
| Propane | 63,2 |
| Gaz naturel | 53.2 |
Animation de combustion
Choisissez un combustible dans le menu déroulant pour voir la réaction nette qui se produit pendant la combustion.
Pour plus de lecture
Pour plus d’informations, veuillez consulter les pages connexes ci-dessous :
- Combustible fossile
- Énergie primaire
- Ressource en hydrocarbures
- Charbon
- Pétrole
- Gaz naturel
- Une page aléatoire
.
Laisser un commentaire