Mots-clés
CADASIL – AVC – IRM
Introduction
Artériopathie cérébrale autosomique dominante avec infarctus sous-corticaux et leucoencéphalopathie (CADASIL) est une maladie héréditaire des petites artères causée par différentes mutations pathogéniques du gène NOTCH-3. Elle se caractérise par l’association de migraines avec aura, de symptômes psychiatriques, d’événements ischémiques récurrents à un âge précoce et de troubles cognitifs. Ce sont ces caractéristiques et les résultats radiologiques typiques qui nous aident normalement à suspecter la maladie. La migraine est généralement considérée comme une maladie des adultes jeunes et d’âge moyen, mais les cas chez les personnes âgées peuvent être sous-diagnostiqués. Nous rapportons le cas d’un homme qui a été diagnostiqué de CADASIL à la fin de ses soixante-dix ans grâce au diagnostic antérieur de sa fille.
Cases Reports
Cas 1
La fille de notre patient avait 50 ans lorsqu’elle a été envoyée dans notre hôpital depuis la clinique ambulatoire de neurologie pour une étude plus approfondie, en raison des résultats radiologiques de son IRM du cerveau, qui consistaient en des changements de la substance blanche dans les deux capsules externes, les zones périventriculaires bilatérales et le lobe temporal gauche.
Elle fréquentait la clinique susmentionnée parce qu’elle souffrait de migraine avec aura visuelle depuis 30 ans, avec certains épisodes suggérant une aura visuelle sans céphalée. Elle n’avait pas d’autres symptômes. Elle était allergique à la phosphomycine et avait subi une amygdalectomie lorsqu’elle était enfant. Elle n’avait pas d’autres antécédents médicaux. Ses antécédents familiaux étaient remarquables : sa mère souffrait de migraine et de démence légère et son père avait eu un accident vasculaire cérébral à l’âge de 75 ans ; son grand-père paternel, son oncle et sa tante avaient eu des accidents vasculaires cérébraux, et l’oncle avait reçu un diagnostic de maladie d’Alzheimer, un cousin paternel avait reçu ailleurs le diagnostic de « vasculite ANA+ » et un autre cousin paternel avait reçu un diagnostic de sclérose en plaques. Elle avait deux fils en bonne santé. L’examen physique, y compris une exploration neurologique méticuleuse, était tout à fait normal. L’IRM répétée du cerveau a montré de multiples lésions hyperintenses dans la substance blanche de la protubérance postérieure, les zones périventriculaires et sous-corticales, y compris les lobes temporaux antérieurs, surtout le gauche, les deux centrum semiovale, les capsules internes et externes, sans aucun signe de microbleeds récents ou passés (figure 1). Tous les autres examens, y compris l’hémogramme, la glycémie, les fonctions hépatique et rénale, la vitesse de sédimentation des érythrocytes, les hormones thyroïdiennes sériques, le dépistage de l’hypercoagulabilité, le dépistage de la vascularite, l’ECG, la radiographie pulmonaire, les sérologies de la syphilis et du VIH, et l’échographie des troncs supra-aortiques avec Doppler, étaient normaux, à l’exception d’une cholestérolémie de 220 mg/dl avec un LDL-cholestérol de 152 mg/dl. La biopsie de la peau était également normale. Une muta tion Arg169Cys (substitution de la cytosine par la thymine dans le codon 505) a été trouvée dans le quatrième exon du gène NOTCH 3, qui est connu pour être pathogène, et elle a donc été diagnostiquée comme CADASIL. Avec ce diagnostic, les deux parents ont été évalués dans notre clinique.
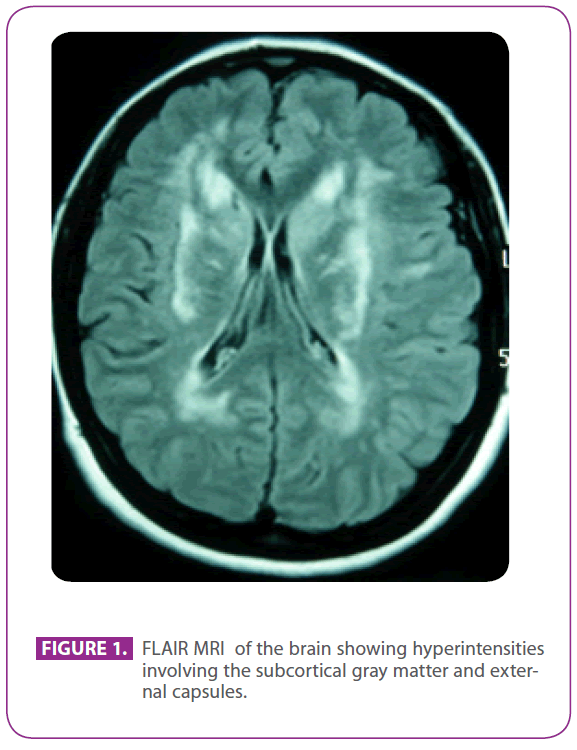
Figure 1 : IRM FLAIR du cerveau montrant des hyperintensifications impliquant la matière grise sous-corticale et les capsules externes.
Cas 2
Sa mère était âgée de 78 ans. Elle avait une longue histoire de migraine sans aura et, au cours des deux dernières années, avait développé une démence légère avec parkinsonisme symétrique, fluctuations et trouble du comportement en sommeil paradoxal, suggérant une démence à corps de Lewy. L’IRM cérébrale a exclu une maladie de la substance blanche pertinente.
Son père était un homme de 79 ans présentant plusieurs facteurs de risque vasculaire : diabète sucré de type 2, dyslipidémie, et un tabagisme depuis 50 ans, avec un indice cumulé de 15 paquets-années, bien qu’il ait arrêté depuis 3 ans. Il avait une cardiopathie ischémique avec un infarctus du myocarde postéro-inférieur en 1991. Au cours des 8 dernières années, il avait eu trois accidents ischémiques transitoires et un accident vasculaire cérébral lacunaire correspondant à différents territoires artériels, avec des troubles progressifs de la marche, et au cours des 6 derniers mois, il était devenu un peu renfermé et apathique. Il n’avait pas d’antécédents de migraine. Il était sous metformine, clopidogrel, aténolol et atorvastatine. A l’examen physique, il était conscient et orienté mais un peu inattentif, le langage et la mémoire lointaine et récente étaient normaux, il présentait une apraxie idéomotrice, une interprétation altérée des similitudes et des paroles, sans réflexes de libération frontale. Il présentait également une hyperréflexie globale avec des réflexes plantaires fléchisseurs bilatéraux, et une démarche avec des pas courts et des mouvements de bras réduits. Un scanner réalisé deux ans auparavant, après l’une de ses attaques ischémiques transitoires, a montré une maladie étendue de la substance blanche, particulièrement proéminente dans la capsule externe et les lobes temporaux (figure 2).
En résumé, le patient présentait des attaques ischémiques récurrentes, une légère déficience cognitive sous-corticale et une leucoencéphalopathie, fortement suspectes de CADASIL compte tenu du diagnostic de sa fille. Un test génétique a été réalisé, qui a montré la même mutation NOTCH 3 que sa fille et a confirmé le diagnostic.
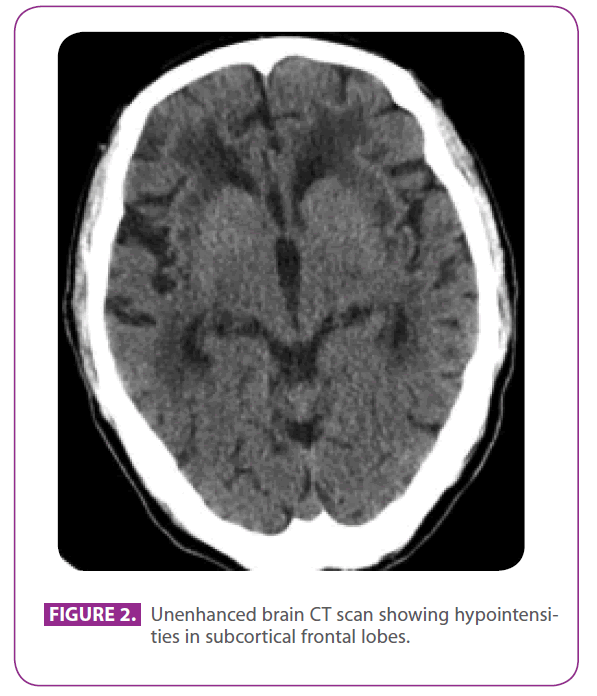
Figure 2 : Tomodensitométrie cérébrale non améliorée montrant des hypointensifications dans les lobes frontaux sous-corticaux.
Discussion
CADASIL est la maladie héréditaire des petits vaisseaux la plus fréquente. Cependant, elle peut également être sporadique, des mutations de novo ayant été décrites. Elle est causée par différentes mutations pathogènes dans le gène NOTCH-3, qui est situé dans le chromosome 19, locus 19p13.2-p13.1, et consiste en 33 exons qui codent pour une protéine de 2321 acides aminés (1). Cette protéine est un récepteur de surface cellulaire transmembranaire à passage unique exprimé dans les cellules musculaires lisses des artères systémiques, avec un domaine régulateur extracellulaire et un domaine transducteur intracellulaire. Plus de 190 mutations susceptibles de conduire à CADASIL ont été signalées à ce jour, et toutes se produisent dans les exons 2 à 24 du gène NOTCH 3, qui codent pour les 34 répétitions de la partie extracellulaire de NOTCH 3, semblables au facteur de croissance épidermique. Par conséquent, le dépistage de ces 23 exons a une sensibilité de 100 % et une spécificité presque identique (2). Parmi ces mutations, plus de 180 sont des mutations faux-sens, au moins 6 délétions, une insertion, un décalage de cadre et 2 duplications. La plupart des mutations pathogènes de NOTCH3 se produisent dans les exons 3 et 4 (3).
Toutes les mutations entraînent une addition ou une perte d’un résidu cystéine dans une répétition de type EGF, et donc un nombre impair de résidus cystéine qui produit la formation de ponts disulfures anormaux. Le mutant NOTCH3 provoque une dégénérescence des cellules lisses vasculaires dans les petites artères et artérioles et une accumulation de la protéine anormale dans la paroi de ces vaisseaux, ce qui entraîne une sténose de la lumière (1). Dans le cerveau, elle affecte les artères cérébrales pénétrantes et leptoméningées, provoquant une incapacité de ces vaisseaux à s’autoréguler et une hypoperfusion des territoires irrigués par ceux-ci, et donc des infarctus dans la substance blanche.
Le premier symptôme de CADASIL, lorsqu’il se présente, est généralement la migraine avec aura, avec un âge moyen de début de 30 ans. Elle apparaît chez 20 à 40% des patients (4). La plupart des attaques sont typiques avec une aura visuelle ou sensorielle, mais la moitié des patients ont également des attaques atypiques avec une aura basilaire, hémiplégique ou prolongée.
Les événements ischémiques sous-corticaux, attaques transitoires ou accidents vasculaires cérébraux, apparaissent chez 60 à 85% des patients, le premier à un âge moyen de 50 ans, bien qu’il puisse se produire dès la deuxième décennie. La plupart du temps, il n’y a pas de facteurs de risque vasculaire conventionnels ou ceux-ci ne sont pas très importants. Chez deux tiers des patients, les événements ischémiques se présentent cliniquement et radiologiquement comme des syndromes lacunaires. La plupart des patients ont plusieurs accidents vasculaires cérébraux, généralement 2 à 5, entraînant au bout de plusieurs années des difficultés de marche, une incontinence urinaire et fécale, une démence et une paralysie pseudobulbaire (1). Les troubles cognitifs sont la deuxième manifestation clinique la plus fréquente. Le signe le plus précoce est généralement l’altération des capacités exécutives et de la vitesse de traitement, qui est présente chez la plupart des patients âgés de plus de 35 ans, mais peut apparaître dès la première décennie de vie (5). Ces troubles cognitifs sont progressifs et s’aggravent normalement avec les AVC récurrents, auxquels s’ajoutent des troubles des activités instrumentales, de la mémoire, du langage, du raisonnement et des capacités visuospatiales. Plus de 70 % des patients sont atteints de démence au cours de la sixième décennie de leur vie. L’aphasie sévère, l’apraxie ou l’agnosie sont rares dans CADASIL.
Des troubles psychiatriques, principalement des troubles de l’humeur, apparaissent chez 20% des patients, en général sous forme d’épisodes dépressifs sévères. L’apathie est présente chez 40% des patients et n’est pas liée à la dépression D’autres manifestations cliniques moins fréquentes sont l’encéphalopathie aiguë réversible (6) (chez 10% des patients), la plupart d’entre elles survenant après une migraine avec aura, les crises d’épilepsie (chez 5 à 10% des patients), la surdité, le parkinsonisme, les hémorragies cérébrales (principalement chez les patients souffrant d’hypertension artérielle) et l’infarctus du myocarde.
Malgré sa pénétrance complète, CADASIL présente une importante variabilité d’expression clinique inter et intrafamiliale. La même mutation NOTCH-3 présente un large spectre clinique, sans différences claires entre les patients homozygotes et hétérozygotes. En fait, il n’existe aucune corrélation entre le génotype et le phénotype clinique (4). La raison de ces différences n’est pas connue, mais certains modificateurs possibles du phénotype de CADASIL ont été décrits, comme le tabagisme actuel pour le risque d’accident vasculaire cérébral et l’âge du premier accident vasculaire cérébral, l’hypertension artérielle pour le risque d’accident vasculaire cérébral, ou les niveaux d’homocystéine pour l’âge d’apparition de la migraine (3,4). Ces facteurs et d’autres pourraient influencer l’expression clinique de la maladie en modifiant l’expression du gène ou en affectant d’autres voies physiopathologiques pouvant conduire aux mêmes manifestations cliniques.
Les changements radiologiques apparaissent chez tous les individus présentant une mutation CADASIL avant 35 ans et augmentent avec le temps. Les caractéristiques les plus précoces et les plus fréquentes sont des zones punctiformes hyperintenses non rehaussées dans la substance blanche cérébrale et les structures sous-corticales sur les images d’IRM pondérées en T2 et à récupération d’inversion atténuée par le fluide. L’implication des capsules externes et de la partie antérieure des lobes temporaux est typique de ces maladies et un indice pour le diagnostic, car ils aident dans le diagnostic différentiel avec d’autres conditions telles que la maladie des petits vaisseaux (1).
CADASIL est généralement considéré comme une maladie des adultes jeunes et d’âge moyen, mais le nombre de patients âgés pourrait être sous-diagnostiqué (7,8). Notre deuxième cas peut servir d’exemple : un patient de 79 ans présentant des facteurs de risque vasculaire et des accidents vasculaires cérébraux récurrents, avec une maladie de la substance blanche qui a été considérée comme secondaire à une maladie des petits vaisseaux par plusieurs neurologues. Le diagnostic n’a été posé qu’après la connaissance de la mutation de sa fille. Dans les cas sans antécédents familiaux clairs , un esprit ouvert et une attention particulière aux résultats radiologiques suggestifs comme l’implication de la capsule externe ou des lobes temporaux antérieurs peuvent être le seul indice pour un diagnostic correct.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009 ; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL : une série de cas de 11 patients. Rev Neurol. 2011 ; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. Spectre clinique de CADASIL et effet des facteurs de risque cardiovasculaire sur le phénotype : étude chez 200 personnes recrutées consécutivement. Stroke 2010 ; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. L’influence des facteurs de risque génétiques et cardiovasculaires sur le phénotype CADASIL. Cerveau. 2004 ; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Le donépézil chez les patients atteints de troubles cognitifs vasculaires sous-corticaux : un essai randomisé en double aveugle dans le cadre de CADASIL. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. « CADASIL coma » : une encéphalopathie aiguë sous-diagnostiquée. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. Homozygotie pour une mutation NOTCH3 chez un patient CADASIL de 65 ans présentant des symptômes légers : un rapport familial. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. L’expressivité remarquablement variable de CADASIL : rapport d’un homme peu symptomatique à un âge avancé. J Neurol. 2009;256:1026-7
Laisser un commentaire