Résultats
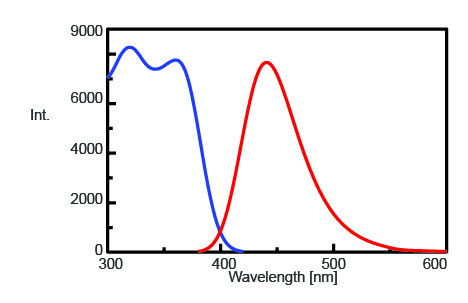
Pour trouver la longueur d’onde d’émission maximale permettant de suivre l’intensité de la fluorescence de l’AMC après clivage par la trypsine, les spectres d’excitation et d’émission ont été mesurés et sont présentés dans la figure 1. La longueur d’onde d’émission maximale s’avère être de 440 nm.
Afin de standardiser l’intensité de fluorescence mesurée de la solution enzymatique à la concentration d’AMC isolée, un titrage a été effectué et la fluorescence mesurée. Des aliquotes de 0,5 mL d’une solution d’AMC à 50 µmol/L ont été ajoutées à une solution enzymatique de 2,5 mL et les concentrations initiales et finales d’AMC isolé sont résumées dans le tableau 1.
Tableau 1. Concentrations d’AMC isolée avant et après la normalisation de l’intensité de fluorescence.
| Concentration initiale | 3 | 6 | 15 | 30 | 60 | 120 | 240 |
| Concentration finale | 0.5 | 1 | 2,5 | 5 | 10 | 20 | 40 |
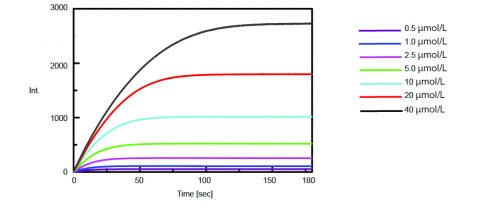
La cinétique de l’activité de la trypsine a ensuite été obtenue en mesurant l’intensité de fluorescence de l’AMC isolé lors du clivage de la trypsine du substrat. La figure 2 montre la mesure de l’évolution temporelle après que 0,5 ml de concentrations variables de la solution de substrat Boc-Gln-Ala-Arg-MCA aient été ajoutées à 2,5 ml de la solution enzymatique.
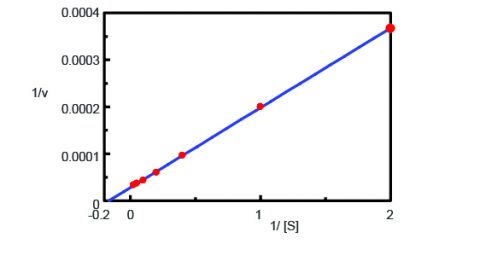
En utilisant le programme d’analyse cinétique, un graphique de Lineweaver-Burk (figure 3) a été tracé à partir des mesures du cours du temps de fluorescence dans la figure 2. Le graphique Lineweaver-Burk fournit des paramètres cinétiques enzymatiques tels que la vitesse maximale de la réaction, Vmax, et la constante de Michaelis-Menten, Km. Vmax décrit la vitesse de la réaction lorsque l’enzyme est saturée de substrat tandis que Km indique la quantité de substrat pour atteindre la vitesse maximale de la réaction. Le Vmax était de 35 270 nmol/L-min-1 et le Km de 5,99. L’équation de la ligne était 1/v = 0,000270 – 1/ + 0,0000284.
Laisser un commentaire