- Introduction
- Expérimental
- Matériaux
- Synthèse des composés d’intercalation
- Caractérisation
- Résultats et discussion
- Caractérisation XRD
- Spectres FTIR
- Modèle structurel des composés d’intercalation Kaol/alkylamine
- Analyse thermique
- Cinétique de la réaction de décomposition
- Conclusions
- Contributions des auteurs
- Déclaration de conflit d’intérêts
- Remerciements
Introduction
La conception et la fabrication de nanocomposites argile/polymère ont suscité un grand intérêt de la part des communautés scientifiques et d’ingénierie (Cheng et al., 2017). Une grande variété de nanocomposites argile/polymère a été développée et fait l’objet d’une application généralisée (Gogoi et Raidongia, 2017). La pré-intercalation des argiles suivie de l’incorporation des polymères dans la couche de minéraux argileux est une approche largement adoptée pour la préparation de nanocomposites argile/polymère (Li et al., 2009 ; Zare et al., 2017). Tout en étant intercalées dans les couches d’argile inorganique, les chaînes de polymères organiques réduisent naturellement leur mobilité structurelle et certaines d’entre elles assument une conformation hautement organisée au sein de la structure en couches.
Dans la nature, la kaolinite (Kaol) est un type de minéral argileux avec une structure en couches de silicate d’aluminium dioctaédrique 1:1 (Brindley et Robinson, 1945). Les couches du Kaol sont maintenues ensemble par des liaisons hydrogène, des interactions dipôle-dipôle et des forces de van der Waals (Brindley et al., 1967). Cependant, seul un nombre limité d’espèces organiques hautement polaires, dont l’urée (Makó et al., 2009), le diméthylsulfoxyde (Costanzo et Giesse, 1986), le formamide (Frost et al., 2000a), l’hydrazine (Cruz et Franco, 2000) et l’acétate de potassium (Frost et al., 2000b) ont été intercalés avec succès dans la galerie du Kaol. L’intercalation de petites molécules dans les couches de Kaol provoque une augmentation de l’espacement basal, et peut être utilisée comme une étape d’expansion préliminaire pour l’insertion ultérieure d’espèces non réactives de grande taille par le déplacement des petites molécules pré-intercalées (Cheng et al., 2015). Par exemple, sur la base des rapports précédents, un composé d’intercalation Kaol/méthanol peut être un intermédiaire efficace pour une réaction d’intercalation ultérieure avec l’éthylène glycol (Hirsemann et al., 2011), l’hexylamine (Matusik et al., 2012), les n-alkylamines (Gardolinski et Lagaly, 2005) et les sels d’ammonium quaternaire (Cheng et al., 2016). En outre, la majorité des molécules invitées sont difficiles à insérer dans l’espace intercouche, une des raisons est la forte liaison hydrogène, une autre est qu’il n’y a pas d’ions échangeables dans la structure du Kaol.
Bien que les nanocomposites argile/polymère aient été bien développés ces dernières années, synthétiser de nouveaux nanocomposites argile/organique pour une application potentielle présente encore un grand défi (Kotal et Bhowmick, 2015). Afin de résoudre ce problème, il est vraiment urgent de comprendre le processus d’intercalation de la kaolinite à l’échelle nanométrique et de mener une enquête approfondie sur le mécanisme de décomposition à l’aide de technologies et d’outils analytiques modernes. L’analyse thermique et le calcul cinétique des composés d’intercalation argile/polymère peuvent aider à caractériser les processus de décomposition et fournir une base scientifique pour le contrôle des réactions d’intercalation (Zhang et al., 2015). Les paramètres cinétiques du processus de réaction de décomposition, tels que l’énergie d’activation, le pré-exponentiel, les ordres de réaction et la constante de vitesse ont été évalués avec les données des thermogrammes argile/polymère. Dans cette étude, l’intercalation du Kaol avec différentes alkylamines a été étudiée. En outre, le processus d’intercalation et le mécanisme de décomposition ont été systématiquement étudiés.
Expérimental
Matériaux
Le kaolin utilisé dans cette étude a été exploité à partir de Zhangjiakou, en Chine. La composition minérale principale est une kaolinite bien ordonnée (95% en masse). Il a été broyé pour passer un tamis de 325 mesh (particules qui mesurent < 44 μm) avant l’intercalation. L’alkylamine hexylamine (HA, 99 %), la dodécylamine (DA, chimiquement pure) et l’octadécylamine (OA, chimiquement pure) ont été achetées auprès de Nanjing Shuguang Chemical Company, en Chine. Le diméthylsulfoxyde (DMSO, réactif analytique), le méthanol (MeOH, réactif analytique) et le toluène (99 %) ont été obtenus auprès de Xilong Chemical Company, en Chine, et utilisés tels quels sans purification supplémentaire. La formule chimique et la formule structurelle de HA, DA, et OA sont indiquées dans le tableau 1.

Tableau 1. Formule chimique et structurelle de HA, DA, et OA.
Synthèse des composés d’intercalation
Premièrement, le composé d’intercalation Kaol/DMSO a été préparé en dispersant 20,0 g de Kaol dans un mélange de 36,0 g de DMSO et 4,0 g d’eau. Le mélange a été agité dans un bain-marie pendant 2 h à 95°C, puis la suspension a été séparée par centrifugation avec de l’éthanol. Deuxièmement, le composé d’intercalation Kaol/DMSO a été utilisé comme précurseur pour une réaction supplémentaire avec MeOH. Du MeOH a été ajouté au Kaol pré-intercalé et le mélange réactionnel a été agité pendant 10 jours, le MeOH étant remplacé chaque jour par une même quantité de MeOH frais. Le précipité dans le mélange a été séparé par centrifugation et séché dans un four à 60°C pendant 12 h pour obtenir des composés d’intercalation Kaol/MeOH. Enfin, 2 g de composé d’intercalation Kaol/MeOH ont été mélangés avec 30,0 ml de solutions de méthanol HA, DA ou OA (1 mol/L) en agitant à température ambiante, respectivement. Les dispersions ont été centrifugées après réaction pendant 24 h. Les sédiments ont été lavés trois fois avec du toluène pour éliminer l’excès de HA, DA ou OA. Les échantillons ont été séchés à température ambiante pendant 12 h et broyés en poudre avec un mortier en agate (Komori et al., 1999). Les composés résultants sont étiquetés comme Kaolpi/HA (pi comme pré-intercalé), Kaolpi/DA, et Kaolpi/OA.
Caractérisation
Les diagrammes XRD ont été enregistrés sur un diffractomètre à rayons X Rigaku D/max 2500PC avec une radiation Cu Kα (λ = 1,54178 Å) fonctionnant à 40 kV et 150 mA. Les échantillons orientés de façon aléatoire ont été balayés dans la gamme 2θ entre 1 et 20° à une vitesse de 2° min-1. Un spectrophotomètre Thermo Fisher Nicolet 6700 a été utilisé pour enregistrer les spectres FTIR dans la gamme de 4.000~400 cm-1. Les analyses TG-DSC ont été réalisées avec un analyseur thermique simultané Mettler-Toledo TG-DSC I/1600 HT sous atmosphère d’azote. Vingt milligrammes d’échantillon ont été placés dans un creuset en alumine et chauffés de 30 à 1 100°C avec une série de vitesses de chauffage à 4, 6, 8, 10°C min-1.
Résultats et discussion
Caractérisation XRD
Les diagrammes XRD du Kaol pristine et de ses composés d’intercalation sont présentés dans la figure 1. Le motif du Kaol pristine présente une structure en couches bien ordonnée avec un espacement basal de 0,71 nm. Cette valeur correspond bien au motif de référence standard de l’ICDD 14-0164 . Après avoir été traité avec du DMSO, un nouveau pic de réflexion basale est apparu à 1,14 nm, indiquant que le DMSO a été inséré avec succès dans les couches intermédiaires du Kaol. Après que le composé d’intercalation Kaol/DMSO ait été traité avec du MeOH, la caractéristique de réflexion de 1,14 nm (001) du composé d’intercalation Kaol/DMSO a été décalée à 0,86 nm. Il a été rapporté par Matusik et al. (2012) que le composé Kaol/DMSO/MeOH a été séché à 110°C, la réflexion avec d = 1,12 nm a disparu et une large réflexion avec un maximum à 0,95 nm a été observée. D’après la formule chimique Al2Si2O5(OH)3.20(OCH3)0.80 du composé d’intercalation Kaol/DMSO qui a été calculée sur la base de l’analyse CHNS, il a été montré qu’environ 1/3 des groupes OH de la surface interne ont été remplacés par des groupes méthoxy, et cette observation suggère également la formation d’un composé d’intercalation Kaol/MeOH (Tunney et Detellier, 1996 ; Cheng et al., 2015). Les diagrammes XRD montrent également que les composés Kaol/MeOH intercalés avec HA, DA et OA étendent la structure le long de l’axe c, conduisant à une grande distance intercouche de 2,86, 4,08 et 5,66 nm, respectivement. Les longueurs des chaînes moléculaires de HA, DA et OA sont respectivement de 1,56, 2,51 et 3,65 nm (McNulty et al., 2011, 2014). Globalement, la distance intercouche des composés d’intercalation Kaol/alkylamine a augmenté avec la longueur de la chaîne alkyle des alkylamines, mais la molécule d’alkylamine n’est pas une structure monocouche ou bicouche qui est perpendiculaire à la surface du Kaol.
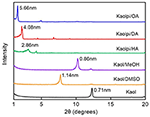
Figure 1. Schémas XRD du Kaol, du Kaol/DMSO, du Kaol/MeOH, du Kaolpi/HA, du Kaolpi/DA et du Kaolpi/OA.
Spectres FTIR
La spectroscopie FTIR a été largement utilisée dans la caractérisation des composés d’intercalation (Ledoux et White, 1964 ; Frost et al., 2000c ; Cheng et al., 2012). Les spectres FTIR du Kaol original, du Kaolpi/HA, du Kaolpi/DA et des composés d’intercalation Kaolpi/OA sont présentés dans la Figure 2. Les bandes caractéristiques à 432, 470, et 541 cm-1 (Figure 2B) appartiennent au mode de déformation de Si-O, Si-O-Si, et Al-O-Si. Les autres bandes à 1 009, 1 031 et 1 114 cm-1 (Figure 2C) sont attribuées aux vibrations d’étirement de Si-O-Si dans la couche de Kaol. En comparant les spectres du Kaol et de ses composés d’intercalation, la position des bandes n’a pas de variation apparente, ce qui indique que ces bandes de vibrations d’étirement ne sont pas affectées par les molécules intercalées.
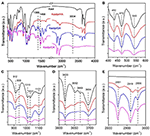
Figure 2. Spectres infrarouges du Kaol, du Kaolpi/HA, du Kaolpi/DA, du Kaolpi/OA.
Les bandes à 912 et 938 cm-1 (Figure 2C) appartiennent à la déformation OH des groupes hydroxyle internes et des groupes hydroxyle de surface interne. Il y a quatre bandes d’étirement d’hydroxyle évidentes à 3,694, 3,669, 3,652, et 3,620 cm-1 (Figure 2D) dans le spectre du Kaol original, les bandes à 3,694, 3,669, et 3,652 cm-1 sont causées par les groupes hydroxyle de surface interne tandis que celle à 3,620 cm-1 résulte des groupes hydroxyle internes (Farmer, 1964 ; Ledoux et White, 1964 ; Giese et Datta, 1973). Après l’intercalation de molécules d’alkylamine, certaines bandes ont été affaiblies en raison du changement des interactions avec les atomes voisins. Le déplacement vers 3 697 cm-1 et la diminution de l’intensité de la bande à 3 694 cm-1 indiquent que de nombreux groupes hydroxyles dans le Kaol ont participé et formé des liaisons hydrogène avec les groupes amines dans les molécules d’alkylamine (Caglar, 2012 ; Caglar et al., 2013 ; Zhang et al., 2015).
La présence de molécules d’alkylamine intercalées a été détectée sur le spectre IRTF par les nouveaux pics, qui sont montrés dans les figures 2A,E. Pour les composés d’intercalation, certains pics caractéristiques évidents tels que la bande à 1 388 et 1 468 cm-1 appartiennent au mode de flexion C-H de -CH3 et -CH2, respectivement. Une nouvelle bande de vibration à 3 334 cm-1 a été observée, qui est due au mode d’étirement de la vibration d’étirement N-H (Griffiths et De Haseth, 2007 ; Zhang et al., 2018). La nouvelle bande de vibration à 2,956 cm-1 a été observée et généralement attribuée à la bande d’étirement asymétrique C-H des groupes méthyles terminaux (Cheng et al., 2016). Les deux bandes de vibration à 2,919 et 2,851 cm-1 sont généralement attribuées aux vibrations d’étirement symétrique et asymétrique du groupe -(CH2)n- (Venkataraman et Vasudevan, 2001). L’intensité des bandes augmente progressivement, ce qui signifie que davantage d’atomes de carbone de l’alkylamine ont été insérés dans les couches intermédiaires du Kaol. En outre, la volatilité des alkylamines diminuera avec l’augmentation de la chaîne de carbone, de sorte que la stabilité des composés d’intercalation Kaol correspondants augmentera progressivement avec une plus grande masse moléculaire d’alkylamine (Wang et al., 2010).
Modèle structurel des composés d’intercalation Kaol/alkylamine
L’arrangement des molécules intercalées est le fondement de l’analyse expérimentale de la structure du composé d’intercalation Kaol/alkylamine. Selon Lagaly (1981), les modèles structurels des composés d’intercalation de montmorillonite-sel d’ammonium quaternaire peuvent être divisés en trois catégories : (a) monocouches : ions alkylamines à chaîne courte ; (b) bicouches : ions ammoniums quaternaires à chaîne longue ; (c) tricouches : chaînes alkyles pliées dans des minéraux argileux fortement chargés. Beneke et Lagaly (1982) ont également proposé différentes structures des molécules d’alkylamine intercalées sur la base de la XRD, qui sont résumées comme suit : (a) les chaînes alkyles dans l’espace intercouche sont inclinées par rapport au plan cristallin (001) ; (b) les chaînes alkyles sont disposées en bicouches. Brindley et Moll (1965) ont décrit que les molécules intercalées sont inclinées par rapport aux feuilles de silicate dans une couche unique, alors que l’angle est d’environ 65° par rapport au plan cristallin (001). Si les molécules intercalées sont uniformément attachées à toutes les surfaces de silicate par les groupes hydroxyle actifs, une organisation « bout à bout » en paires avec un certain déplacement longitudinal est suggérée. L’angle d’inclinaison est en accord avec le mode d’emballage étroit possible entre les surfaces d’oxygène du silicate et les groupes hydroxyle terminaux et le degré d’emballage étroit des molécules de la chaîne entre elles.
Les molécules d’alkyle sont difficiles à intercaler directement les couches originales de Kaol puisqu’il manque d’ions échangeables dans l’espace intercouche du Kaol. Des précurseurs valides sont essentiels lorsque les molécules d’alkylamine s’insèrent dans la couche intermédiaire du Kaol. Il a été signalé que la chaîne de chlorure d’alkyl triméthyl ammonium forme une bicouche inclinée dans la couche intermédiaire du Kaol et que l’angle d’inclinaison est de ~36° après calcul (Kuroda et al., 2011). Yuan et al. (2013) ont souligné que l’arrangement structurel des molécules de sel d’ammonium quaternaire dans l’intercouche du Kaol forme une bicouche inclinée et l’angle d’inclinaison est de ~38,4°. Gardolinski et Lagaly (2005) ont proposé que les chaînes alkyle dans les intercouches soient entièrement étirées et orientées perpendiculairement à la surface du Kaol par bicouche. Par conséquent, en analysant la longueur de la chaîne des molécules HA, DA et OA, on peut conclure que l’espacement basal après l’intercalation n’est pas suffisant pour permettre à la chaîne alkylique d’entrer de manière verticale et bicouche. Une analyse plus approfondie des résultats de la XRD montre que les chaînes alkyles de HA, DA et OA sont inclinées vers la surface du Kaol dans la bicouche et que l’angle d’inclinaison des chaînes alkyles est d’environ 39,9, 39,9 et 41,1°, respectivement. En outre, en raison de la liaison hydroxyle entre l’hydroxyle de la surface interne du Kaol et les groupes amine des molécules d’alkylamine, le modèle structurel le plus possible pour les composés d’intercalation Kaol/alkylamine est représenté sur la figure 3.
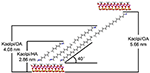
Figure 3. Le modèle structurel le plus possible pour les composés d’intercalation kaolinite/alkylamine.
Analyse thermique
Les résultats de l’analyse TG-DSC du Kaol et de ses composés d’intercalation sont présentés dans la Figure 4. La principale perte de masse du Kaol est celle comprise entre 400 et 600°C avec le taux de perte maximal à 525°C attribué à la perte d’eau en raison de la déshydroxylation du réseau cristallin, entraînant la formation de méta-kaolinite (Toussaint et al, 1963 ; Criado et al, 1984 ; Sperinck et al, 2011). Cette perte correspond à environ 12,7% de la masse totale, ce qui est extrêmement proche de la référence théorique (13,9%). En comparant les courbes TG-DSC du Kaol original, deux étapes principales de perte de masse sont observées dans celle des composés d’intercalation Kaolpi/HA, Kaolpi/DA et Kaolpi/OA. La première s’est produite entre 150 et 350°C, ce qui est dû à la décomposition des molécules d’alkylamine intercalées (Yuan et al., 2013). La seconde, survenue à environ 500°C, est due à la déshydroxylation du Kaol désintercalé. Pour le Kaolpi/OA, certains OA ont été intercalés dans l’espace intercouche de silicate pour former une intercalation stable, ce qui peut être prouvé par le schéma XRD. Certaines molécules sont enchevêtrées les unes dans les autres en raison de la longue chaîne ou d’une pince dans les nano-rouleaux qui ne peuvent pas être entièrement retirées (Li et al., 2015 ; Liu et al., 2016). À 220°C, la perte de masse distincte est due à la décomposition de l’OA enrobé ou non lié, tandis que la perte de masse à 330°C est attribuée à la décomposition de l’OA intercalé. Le pic exothermique à 996°C résulte de la recristallisation du Kaol.
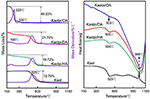
Figure 4. Courbes TG-DSC pour Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
En comparant les courbes TG-DSC du Kaol original et des composés d’intercalation Kaol/alkylamine (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA), on peut observer : (a) qu’il présente différentes étapes de perte de masse, ainsi qu’une différence significative dans les pertes de masse entre Kaolpi/OA et les deux autres composés d’intercalation (Kaolpi/HA, Kaolpi/DA). La perte de masse pour la décomposition de Kaolpi/HA et Kaolpi/DA était d’environ 20%, mais la quantité des deux pertes de masse pour Kaolpi/OA est d’environ 50%. Cela pourrait être dû au fait qu’une plus grande quantité d’OA a été intercalée dans l’espace intercouche du silicate que celle de HA et DA (Wang et al., 2017). (b) La température de déshydroxylation des composés d’intercalation était inférieure d’environ 20°C à celle du Kaol original. Cela s’explique par le fait que les molécules d’intercalation ont élargi l’espacement entre les couches, affaibli les liaisons hydrogène entre les couches de Kaol, entraînant une déshydroxylation plus facile de la surface du Kaol. Par conséquent, la cristallinité du Kaol a fortement diminué après l’intercalation, ce qui peut être confirmé par XRD et IR (en dessous de 800 cm-1). Ce résultat est cohérent avec la conclusion de certains autres rapports selon lesquels la température de déshydroxylation était déterminée par la cristallinité du Kaol (Yeskis et al., 1985 ; Gabor et al., 1995 ; Sahnoune et al., 2012).
Cinétique de la réaction de décomposition
La cinétique de dégradation du composé d’intercalation Kaol/alkylamine a été étudiée par des techniques de thermogravimétrie. Les paramètres cinétiques (énergie d’activation E et le facteur pré-exponentiel A) du processus de dégradation ont été calculés sur la base des méthodes KAS et Ozawa (Kissinger, 1957 ; Škvára et Šesták, 1975). Le mécanisme de dégradation thermique du composé d’intercalation Kaol/alkylamine a été étudié avec la méthode intégrale de Satava (Xie et al., 2001 ; Gao et al., 2005 ; Zhang et al…, 2015).
Selon la théorie de la réaction, la formule cinétique de décomposition non isotherme est généralement exprimée comme suit :
où α est l’étendue du taux de conversion de B(s) au temps t, f (α) est la fonction du mécanisme de réaction, et k est la constante de vitesse de réaction. k obéit à l’équation suivante :
Si la température de l’échantillon est contrôlée à une vitesse de chauffage constante (β = dT/dt), la vitesse de réaction peut être définie comme suit :
Après séparation de la variable, réarrangement avec fonctions intégrales ou différentielles de l’équation (4), l’équation de KAS (5) et l’équation d’Ozawa (6) peuvent être calculées comme suit :
Où G(α) représente la fonction intégrale de conversion. En raison de l’approximation intégrale, des méthodes itératives ont été utilisées pour calculer E afin d’éviter certaines déviations. Les fonctions des méthodes itératives sont les suivantes:
Set x = E/RT, la définition de h(x) et H(x) sont:
L’itération sont comme les trois étapes suivantes:
(a) Définir h(x) = 1 ou H(x) = 1, calculer E0 par la méthode des moindres carrés selon la pente de la relation linéaire lnβ/T2 et lnβ à 1/T.
(c) Remplacer E0 par E1, répéter l’étape (b) jusqu’à ce que Ei-Ei-1 < 0. 1 kJ mol-1. Ei est la valeur exacte de l’énergie d’activation de la réaction de décomposition.
Les valeurs de E des composés d’intercalation Kaol/alkylamine ont été calculées par les méthodes KAS, Ozawa et itérative (tableau 2). Les résultats calculés obtenus par la méthode KAS étaient plus proches des résultats des méthodes itératives, cependant, les résultats de la méthode itérative d’Ozawa ont montré une plus grande déviation par rapport aux autres. Par conséquent, la moyenne E des méthodes itératives peut être considérée comme l’énergie d’activation de la réaction de décomposition puisqu’elles constituent une amélioration par rapport aux méthodes KAS et Ozawa. Les E moyennes de Kaolpi/HA, Kaolpi/DA et Kaolpi/OA sont de 104,44, 130,80 et 154,59 kJ mol-1. On peut voir que les E moyens des composés Kaol/alkylamine sont en corrélation positive avec la longueur de la chaîne alkyle. L’une des raisons est que la volatilité s’affaiblit avec la croissance de la chaîne alkyle. Une autre raison est que le Kaolpi/OA possède la meilleure structure d’intercalation bien ordonnée qui est la plus difficile à désintercaler. Et ces résultats peuvent être confirmés par les diagrammes XRD.
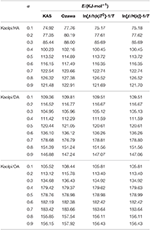
Tableau 2. E des composés d’intercalation Kaol/alkylamine avec différents α calculés par les méthodes KAS, Ozawa et itération.
Les fonctions et A du mécanisme de réaction de décomposition ont été calculées par les méthodes Satava, qui a été décrit comme suit:
Substituer α dans chaque fonction de mécanisme G(α) pour obtenir la valeur de lg, l’ajustement linéaire lg, et 1/T qui correspond à la vitesse de chauffage, la fonction qui a le plus grand ajustement peut être déterminée comme la fonction de mécanisme la plus probable. Et les valeurs de E et A peuvent être obtenues par la pente et l’intercept d’une courbe d’ajustement linéaire.
Comme le montre le tableau 3, cinq fonctions de mécanisme avec une qualité d’ajustement supérieure à 90% sont choisies sur la base de la formule intégrale de Satava. En comparant ces cinq fonctions, la fonction de mécanisme n°9 G(α) = 2 avec une qualité d’ajustement d’environ 97% peut être considérée comme la fonction de mécanisme la plus probable, et les courbes d’ajustement linéaire de la fonction n°9 ont été montrées dans la Figure 5. E et A sont également dans la plage normale de la cinétique de décomposition. Les fonctions de mécanisme de décomposition pour les trois composés d’intercalation Kaol/alkylamine sont données dans le tableau 4.

Tableau 3. Fonctions de mécanisme cinétique sélectionnées jugées par la méthode intégrale de Satava.

Figure 5. Courbes d’ajustement linéaire de la fonction n°9 jugée par la méthode intégrale Satava.

Tableau 4. Fonctions des mécanismes cinétiques des composés d’intercalation Kaol/alkylamine.
Conclusions
Les modèles de structure possibles et les cinétiques de décomposition des composés d’intercalation Kaol/alkylamine ont été étudiés en utilisant la XRD, la FT-IR et la TG-DSC. L’intercalation du composé Kaol/MeOH avec HA, DA et OA élargit l’espacement intercouche du Kaol le long de l’axe c, ce qui entraîne l’apparition de la réflexion dominante à 2,86, 4,08 et 5,66 nm, respectivement. De plus, l’espacement basal après l’intercalation n’est pas suffisant pour permettre l’entrée des chaînes alkyles par voie verticale simple et bicouche. On a conclu que les chaînes alkyles de HA, DA et OA sont inclinées vers la surface du Kaol en bicouche et que l’angle d’inclinaison des chaînes alkyles est de ~40°.
Sur la base des méthodes KAS, Ozawa et itératives, les résultats de l’énergie d’activation E des composés d’intercalation Kaol/alkylamine ont été calculés. L’énergie d’activation moyenne E du Kaolpi/HA, du Kaolpi/DA et du Kaolpi/OA est de 104,44, 130,80 et 154,59 kJ mol-1. L’énergie d’activation moyenne E parmi les composés Kaol/alkylamine a une corrélation positive avec la longueur de la chaîne alkyle. La fonction de mécanisme optimisée du processus de décomposition du Kaol/alkylamine a été déterminée comme une diffusion 3D avec la fonction intégrale G(α) = 2. Cette recherche est avantageuse pour mieux comprendre le mécanisme de décomposition des nanocomposites argileux/organiques en plus de fournir une inspiration pour synthétiser de nouveaux matériaux à base d’argile.
Contributions des auteurs
HC et QfL ont conçu l’expérience et révisé l’article. YZ, QhL et PX ont réalisé les expériences et rédigé l’article. YZ et QhL ont contribué à parts égales à ce travail.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Le Dr Luyi Sun (Département de génie chimique et biomoléculaire et Programme des polymères, Institut des sciences des matériaux, Université du Connecticut) est remercié pour la révision de l’article. Les auteurs reconnaissent avec gratitude le soutien financier fourni par la Fondation nationale des sciences naturelles de Chine (41602171), la Fondation des sciences naturelles de Beijing (8164062) et le projet Yue Qi Young Scholar, Université chinoise des & technologies minières, Beijing.
Giese, R., et Datta, P. (1973). Orientation hydroxyle dans la kaolinite, la dickite et la nacrite. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). La spectrométrie infrarouge à transformée de Fourier. New York, NY : John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., et Guggenheim, S. (1985). Déshydroxylation de la kaolinite. Am. Mineral. 70, 1-2.
Google Scholar
Laisser un commentaire