Forces dipôle – dipôle
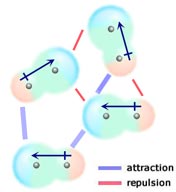
Si deux molécules neutres, ayant chacune un moment dipolaire permanent, se rapprochent de telle sorte que leurs extrémités de charge opposée s’alignent, elles seront attirées l’une vers l’autre. Dans un liquide ou un solide, ces alignements sont favorisés par rapport à ceux où les extrémités de même charge des molécules sont proches et donc se repoussent.
Une des raisons pour lesquelles CH3F a un point d’ébullition plus élevé (-84 °C) que CF4 (-128 °C) est que CF3H a un moment dipolaire permanent, alors que CF4 n’en a pas. Pour bien comprendre cela, vous devez savoir que CF4 est de forme tétraédrique et que CH3F est grossièrement tétraédrique (il n’y a pas une grande différence dans les formes de ces molécules). Les liaisons carbone-fluor des deux molécules sont polaires (le fluor est beaucoup plus électronégatif que le carbone), mais la présence de quatre liaisons C-F dans la molécule tétraédrique CF4 rend la molécule globalement non polaire. Le moment dipolaire de l’unique liaison C-F dans CH3F n’est pas annulé par les dipôles des liaisons C-H (qui sont très faibles) donc CH3F a bien un moment dipolaire permanent.
Un type de force intermoléculaire qui peut apparaître dans des circonstances particulières et qui est généralement classé comme une interaction dipôle-dipôle, bien qu’il ait un certain caractère de liaison covalente est la liaison hydrogène.
Laisser un commentaire