14.8 Ethers
Objectifs pédagogiques
- Décrire la différence structurelle entre un alcool et un éther qui affecte les caractéristiques physiques et la réactivité de chacun.
- Nommer les éthers simples.
Décrire la structure et les utilisations de certains éthers.
Avec la formule générale ROR′, un étherComposé organique qui a un atome d’oxygène entre deux groupes hydrocarbonés. peut être considéré comme un dérivé de l’eau dans lequel les deux atomes d’hydrogène sont remplacés par des groupes alkyle ou aryle. Il peut également être considéré comme un dérivé d’un alcool (ROH) dans lequel l’atome d’hydrogène du groupe OH a été remplacé par un second groupe alkyle ou aryle :
HOH→Atomes Hreplace bothROR′←of OH groupreplace H atomROH
Les éthers simples ont des noms communs simples, formés à partir des noms des groupes attachés à l’atome d’oxygène, suivis du nom générique éther. Par exemple, CH3-O-CH2CH2CH3 est l’éther méthylpropylique. Si les deux groupes sont identiques, le nom du groupe doit être précédé du préfixe di-, comme dans l’éther diméthylique (CH3-O-CH3) et l’éther diéthylique CH3CH2-O-CH2CH3.
Les molécules d’éther n’ont pas d’atome d’hydrogène sur l’atome d’oxygène (c’est-à-dire pas de groupe OH). Il n’y a donc pas de liaison hydrogène intermoléculaire entre les molécules d’éther, et les éthers ont donc des points d’ébullition assez bas pour une masse molaire donnée. En effet, les éthers ont des points d’ébullition à peu près identiques à ceux des alcanes de masse molaire comparable et beaucoup plus bas que ceux des alcools correspondants (tableau 14.4 « Comparaison des points d’ébullition des alcanes, des alcools et des éthers »).
Tableau 14.4 Comparaison des points d’ébullition des alcanes, des alcools et des éthers
| Formule structurale condensée | Nom | Masse molaire | Point d’ébullition (°C) | La liaison hydrogène intermoléculaire dans le liquide pur ? |
|---|---|---|---|---|
| CH3CH2CH3 | propane | 44 | -42 | no |
| CH3OCH3 | diméthyléther | 46 | -25 | non |
| CH3CH2OH | alcool éthylique | 46 | 78 | oui |
| CH3CH2CH2CH2CH3 | pentane | 72 | 36 | non |
| CH3CH2OCH2CH3 | éther diéthylique | 74 | 35 | non |
| CH3CH2CH2CH2OH | alcool butylique | 74 | 117 | oui |
Les molécules d’éther ont bien un atome d’oxygène, cependant, et s’engagent dans une liaison hydrogène avec les molécules d’eau. Par conséquent, un éther a à peu près la même solubilité dans l’eau que l’alcool qui lui est isomère. Par exemple, l’éther diméthylique et l’éthanol (tous deux ayant la formule moléculaire C2H6O) sont complètement solubles dans l’eau, tandis que l’éther diéthylique et le 1-butanol (tous deux C4H10O) sont à peine solubles dans l’eau (8 g/100 ml d’eau).
Exemple 5
Quel est le nom commun de chaque éther ?
- CH3CH2CH2OCH2CH2CH3
-
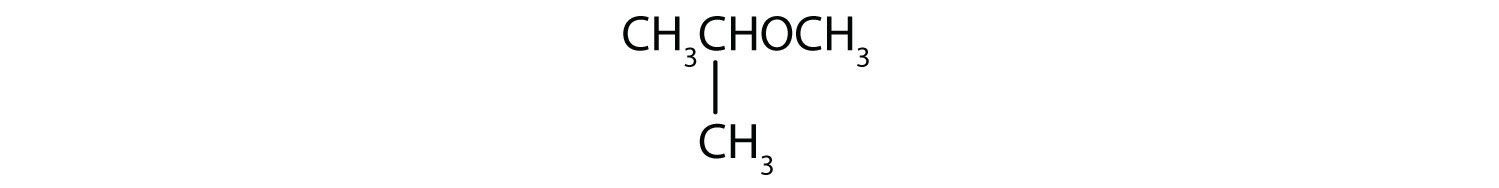
Solution
- Les groupes carbonés de part et d’autre de l’atome d’oxygène sont des groupes propyle (CH3CH2CH2), le composé est donc l’éther dipropylique.
- Le groupe à trois carbones est attaché par l’atome de carbone central, c’est donc un groupe isopropyle. Le groupe à un carbone est un groupe méthyle. Le composé est l’isopropyl méthyl éther.
Exercice de construction de compétences
-
CH3CH2CH2CH2OCH2CH2CH2CH3
-
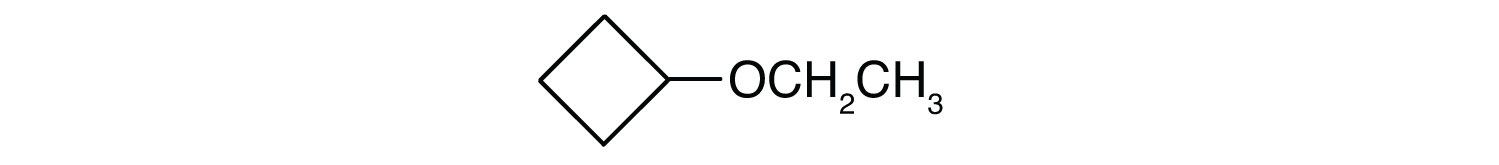
À votre santé : Les éthers comme anesthésiques généraux
Un anesthésique général agit sur le cerveau pour produire une inconscience et une insensibilité générale aux sensations ou à la douleur. L’éther diéthylique (CH3CH2OCH2CH3) a été le premier anesthésique général à être utilisé.
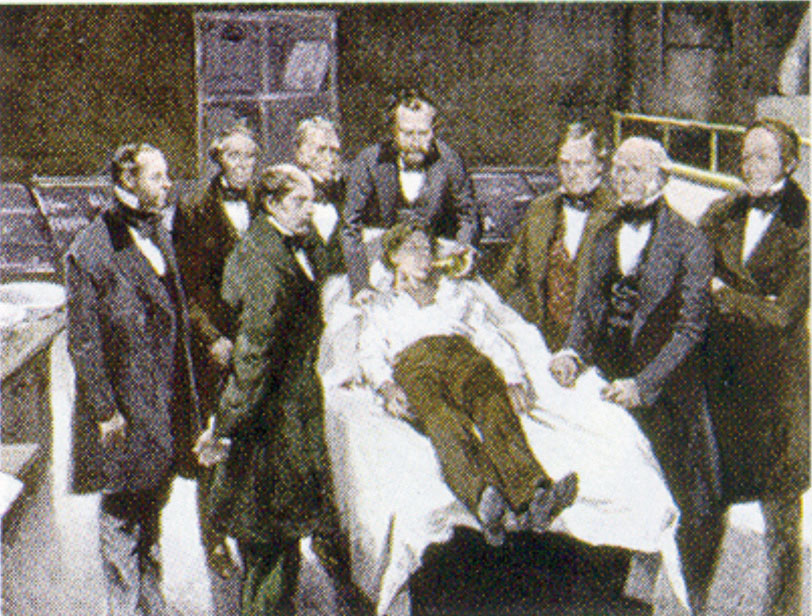
William Morton, un dentiste de Boston, a introduit l’éther diéthylique dans la pratique chirurgicale en 1846. Cette peinture montre une opération à Boston en 1846 dans laquelle l’éther diéthylique a été utilisé comme anesthésique. L’inhalation de vapeur d’éther produit une perte de conscience en déprimant l’activité du système nerveux central.
Source : Peinture de William Morton par Ernest Board, de http://commons.wikimedia.org/wiki/File:Morton_Ether_1846.jpg.
L’éther diéthylique est relativement sûr parce qu’il y a un écart assez large entre la dose qui produit un niveau efficace d’anesthésie et la dose létale. Cependant, comme il est hautement inflammable et qu’il présente l’inconvénient supplémentaire de provoquer des nausées, il a été remplacé par de nouveaux anesthésiques par inhalation, notamment les composés fluorés halothane, enflurane et isoflurane. Malheureusement, la sécurité de ces composés pour le personnel des salles d’opération a été remise en question. Par exemple, les travailleuses de salle d’opération exposées à l’halothane souffrent d’un taux de fausses couches plus élevé que les femmes de la population générale.
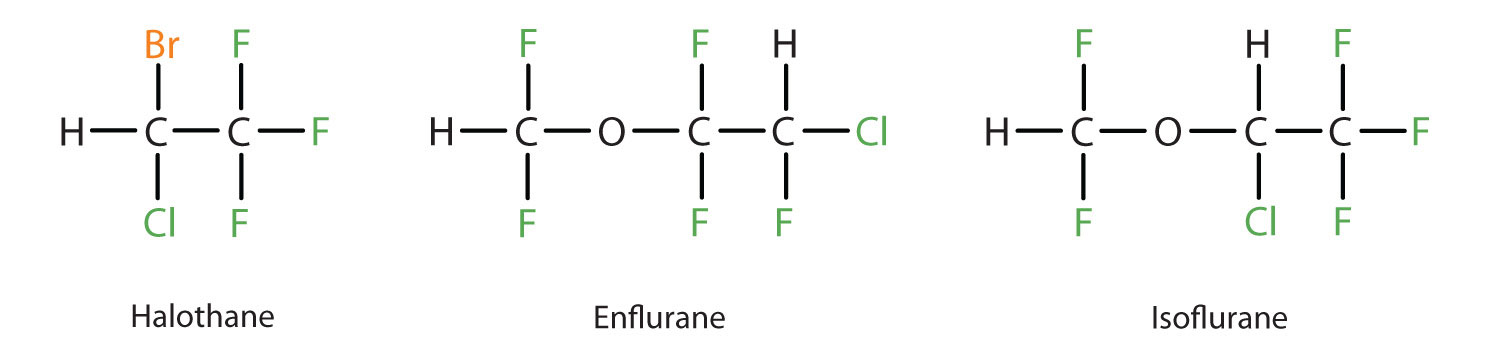
Ces trois composés anesthésiques modernes, inhalés, contenant des halogènes, sont moins inflammables que l’éther diéthylique.
Exercices de révision de concepts
-
Pourquoi l’éther diéthylique (CH3CH2OCH2CH3) a-t-il un point d’ébullition beaucoup plus bas que le 1-butanol (CH3CH2CH2CH2OH) ?
-
Qu’est-ce qui est le plus soluble dans l’eau : l’éther méthylique (CH3CH2OCH3) ou le 1-butanol (CH3CH2CH2CH2OH) ? Expliquez.
Réponses
-
L’éther diéthylique n’a pas de liaison hydrogène intermoléculaire car il n’y a pas de groupe OH ; le 1-butanol a un OH et s’engage dans une liaison hydrogène intermoléculaire.
-
L’éther méthylique d’éthyle (trois atomes de carbone, un atome d’oxygène) est plus soluble dans l’eau que le 1-butanol (quatre atomes de carbone, un atome d’oxygène), même si les deux peuvent s’engager dans une liaison hydrogène avec l’eau.
Points clés
- Pour donner des noms communs aux éthers, il suffit de nommer les groupes attachés à l’atome d’oxygène, suivis du nom générique éther. Si les deux groupes sont identiques, le nom du groupe doit être précédé du préfixe di-.
- Les molécules d’éther n’ont pas de groupe OH et donc pas de liaison hydrogène intermoléculaire. Les éthers ont donc des points d’ébullition assez bas pour une masse molaire donnée.
- Les molécules d’éther ont un atome d’oxygène et peuvent s’engager dans une liaison hydrogène avec les molécules d’eau. Une molécule d’éther a à peu près la même solubilité dans l’eau que l’alcool qui lui est isomère.
Exercices
-
Comment l’éthanol peut-il donner deux produits différents lorsqu’il est chauffé avec de l’acide sulfurique ? Nommez ces produits.
-
Lequel de ces éthers est isomère avec l’éthanol-CH3CH2OCH2CH3, CH3OCH2CH3 ou CH3OCH3 ?
-
Nommer chaque composé.
- CH3OCH2CH2CH3
-
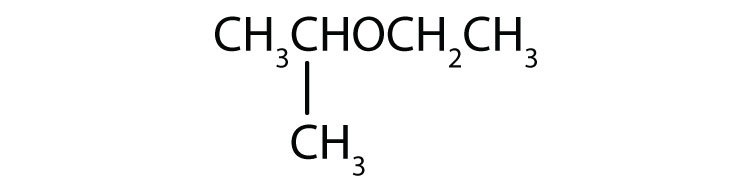
-
Nommer chaque composé.
- CH3CH2CH2CH2OCH3
- CH3CH2OCH2CH2CH3
-
Dessinez la structure de chaque composé.
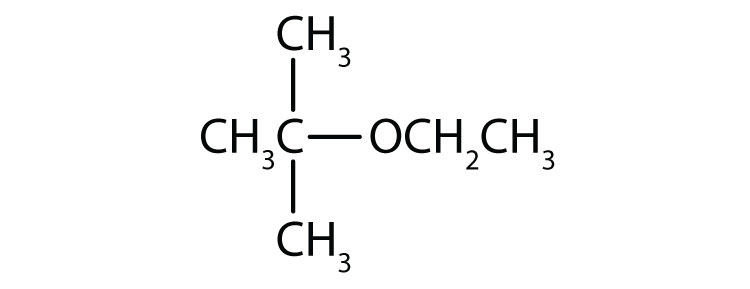
- éther éthylique de méthyle
- éther éthylique de tert-butyle
-
Dessinez la structure de chaque composé.
- éther diisopropylique
- éther cyclopropylique propylique
Réponses
-
La déshydratation intramoléculaire (le H et le OH proviennent de la même molécule) donne l’éthylène ; intermoléculaire (le H provient d’une molécule et le OH d’une autre molécule) la déshydratation donne l’éther diéthylique.
-
- éther méthylpropylique
- éther éthylique isopropylique
.
-
- CH3OCH2CH3
-
.
-
Quel est le nom commun de chaque éther ?
Laisser un commentaire