PARLEMENTS ORIGINAUX
Détection de l’antigène de surface de l’hépatite B en utilisant des sérums groupés. Une analyse coûts-avantages
E. Fernández, L. Rodrigo1, S. García, S. Riestra1 et C. Blanco
Service de biochimie. Hôpital de Cabueñes. Gijón. 1Service de gastro-entérologie. Hôpital Central des Asturies. Oviedo. Espagne
Correspondance
ABSTRACT
Objectifs : examiner la faisabilité et effectuer une analyse coût-bénéfice d’une stratégie de regroupement de 5 échantillons utilisant un dosage immunoenzymatique (EIA) pour le dépistage de l’antigène de surface de l’hépatite B (HBsAg).
Matériel et méthodes : pour évaluer la sensibilité et la spécificité de la méthode de pooling, chacun des 40 sérums positifs (de faiblement à intensément positifs à l’Ag HBs) et 250 sérums négatifs ont été testés dans un pool avec 4 sérums négatifs à l’Ag HBs. La limite de détection de l’Ag HBs/ad et de l’Ag HBs/ay a été évaluée en utilisant des sérums provenant d’un panel de sous-types purifiés. Une étude en conditions réelles a été réalisée à partir de pools provenant de 340 femmes enceintes.
Résultats : la sensibilité et la spécificité de cette technique étaient de 100%. Le coefficient de corrélation entre les rapports échantillon/coupe de 40 échantillons étudiés en conditions simples et en conditions groupées était de 0,792 (p < 0,005). La méthode de pooling présente des niveaux de détection plus faibles pour l’HBsAg/ad et l’HBsAg/ay, soit 0,20 ng/mL et 0,12 ng/mL, et la méthode simple, soit 0,34 ng/mL et 0,29 ng/mL, respectivement. La méthode de pooling ne perd aucune sensibilité pour des valeurs allant jusqu’à 100 UI/L d’anti-HBs dans les quatre sérums mélangés à un sérum positif. L’analyse coût-bénéfice a montré que la méthode de pooling pouvait permettre d’économiser de 30% à 75% du coût de la détermination de l’Ag HBs, selon que les séroprévalences étaient respectivement de 10% ou de 1%.
Conclusions : le test EIA de l’AgHBs groupé n’a pas donné de moins bons résultats que le test EIA unique, et a constitué une stratégie rentable et valide dans les régions où la prévalence est élevée, moyenne ou faible.
Mots clés : Antigène de surface de l’hépatite B. Mise en commun des sérums. Analyse coût-bénéfice.
Rodrigo L, Fernández E, García S, Riestra S, Blanco C. Détection de l’antigène de surface de l’hépatite B à l’aide de sérums groupés. A cost-benefit analysis. Rev Esp Enferm Dig 2006 ; 98 : 112-121.
Introduction
L’infection par le virus de l’hépatite B (VHB) est une maladie qui touche des millions de personnes dans le monde. Son principal réservoir est celui des porteurs chroniques du VHB. On estime qu’environ 300 millions de personnes dans le monde sont infectées par ce virus (1). Les conséquences médicales de l’infection par le VHB sont à la fois variables et imprévisibles, en fonction de facteurs tels que l’âge du patient et son statut immunitaire. Le VHB est un agent étiologique bien reconnu de l’hépatite chronique, de la cirrhose du foie et du carcinome hépatocellulaire.
De grandes différences existent cependant dans la prévalence de l’infection, ce qui a conduit à l’établissement de trois grandes zones de forte, moyenne et faible endémicité (2). Dans la plupart des pays développés, la prévalence des porteurs chroniques du VHB est inférieure à 2 % et la transmission de l’infection se fait surtout chez les adultes appartenant à certains groupes à risque (usagers de drogues, homosexuels masculins, hétérosexuels libertins, personnel de santé) (3). En Espagne, on a constaté une prévalence de 1,2 % de porteurs du VHB (4), et l’identification de l’AgHBs chez les donneurs de sang, les femmes enceintes et les sujets soumis à des programmes d’auto-transfusion est obligatoire.
La technique du pooling de sérums tente de réduire les coûts sans perdre en efficacité, et a été principalement utilisée dans les pays en voie de développement dans la recherche d’anticorps contre le virus de l’immunodéficience humaine (VIH) (5-14), et le virus de l’hépatite C (VHC) (15-19). Les résultats obtenus avec cette méthode se sont avérés très prometteurs, car ils ont permis de réduire considérablement le coût des tests de laboratoire sans diminuer significativement leur sensibilité.
La présente étude tente d’évaluer si la technique du pooling de sérum est applicable dans la détection de l’Ag HBs, d’élucider les facteurs qui peuvent modifier sa sensibilité, et de réaliser une analyse coût-bénéfice pour cette technique de diagnostic.
Matériel et méthodes
Détermination de l’Ag HBs
Le test Imx HBsAg (Abbott Laboratories, Abbott Park, IL), qui est un test immunoenzymatique (EIA) qualitatif à microparticules de troisième génération, a été utilisé pour l’évaluation de l’Ag HBs. La présence ou l’absence de l’Ag HBs est déterminée en comparant le taux de formation du produit fluorescent à un seuil, qui est calculé à partir du taux de calibrateur négatif (N) (plasma humain non réactif pour l’Ag HBs). Le test Imx HBsAg calcule un rapport entre le taux de l’échantillon (S) et le taux du calibrateur négatif. La valeur seuil (S/N) a été établie à 2 pour l’EIA à sérum unique.
La technique de pooling est réalisée en ajoutant 200 mcL au pool, c’est-à-dire en obtenant un mélange de 40 mcL de chacun des 5 sérums composant le pool (dilution 1/5). Le seuil a été établi comme la moyenne des échantillons négatifs plus 3 écarts types, ce qui donne une valeur de 1. On considère donc qu’il existe un échantillon non réactif dans ce groupe de 5 lorsque le coefficient S/N est < valeur seuil, alors qu’un pool S/N > seuil peut indiquer la présence d’au moins un échantillon réactif. Dans ce cas, il est nécessaire de retester les échantillons individuels afin d’identifier le ou les échantillons réactifs. Tous les tests sont effectués en double exemplaire.
Conformément à ce qui précède, la spécificité a été évaluée par l’évaluation de l’Ag HBs dans 50 pools de 250 sérums négatifs. Pour calculer la sensibilité, 40 sérums présentant la même distribution de concentration que la population générale dans laquelle ils ont été prélevés ont été testés dans un pool de 4 sérums négatifs.
Sous-types d’Ag HBs (ad et ay)
La limite de détection de l’Ag HBs Imx pour ad et ay a été évaluée en utilisant des sérums provenant d’un panel de sous-types d’Ag HBs purifiés (panel de sensibilité à l’Ag HBs de l’hépatite, Laboratoires Abbott). Les concentrations d’HBsAg/ad et d’HBsAg/ay variaient respectivement de 0,13 à 2,32 ng/mL et de 0,21 à 2,24 ng/mL. La limite de détection a été déterminée en simple et dans un pool avec 4 sérums négatifs pour l’Ag HBs.
Influence du taux d’anti-HBs
Afin de vérifier si l’existence d’anticorps anti-HBs dans les sérums étudiés à l’aide du test groupé pouvait neutraliser l’HBsAg et interférer avec la sensibilité de la technique, nous avons appliqué la méthode de groupage d’un sérum ayant une concentration connue d’HBsAg/ad et HBsAg/ay avec quatre sérums ayant des titres connus d’anti-HBs.
La détermination quantitative des anti-HBs a été effectuée par une méthode d’immuno-essai enzymatique sur microparticules (mEIA) à l’aide d’un auto-analyseur AxSYm (AxSYmTM AUSAB, Abbott Laboratories, Abbott Park, IL). Les sérums présentant des titres élevés d’anti-HBs ont été obtenus à partir de témoins VHB post-vaccinés et de patients ayant guéri de l’hépatite B.
Test de pool dans le dépistage de l’Ag HBs
Afin d’évaluer la validité du test de pool, une simulation des opérations sur le terrain a été réalisée en utilisant la méthode ci-dessus sur 1 525 échantillons de sérum obtenus auprès de femmes enceintes dans le cadre d’une étude précédente que nous avons menée pour estimer la prévalence de l’infection par le VHC, et dont les échantillons ont été conservés à -20 ºC depuis leur collecte. Nous avons sélectionné au hasard parmi ces échantillons 300 échantillons négatifs et 14 échantillons positifs pour l’AgHBs. Les déterminations ont été faites sans connaissance préalable des compositions des pools.
Réduction du nombre de tests
Lorsqu’un pool donne un résultat positif, il est nécessaire de retester individuellement chaque composant afin d’identifier le ou les échantillons positifs à l’Ag HBs. Ainsi, plus le nombre de pools positifs est élevé (c’est-à-dire la prévalence de l’Ag HBs), plus la réduction du nombre de tests effectués est faible.
Sur cette base, le pourcentage de réduction du nombre de tests lors de l’utilisation de pools de sérums pour le dépistage de l’Ag HBs, a été calculé dans les conditions les plus défavorables et les plus improbables (faible prévalence), c’est-à-dire lorsque pas plus d’un sérum positif n’était présent dans aucun des pools. Par exemple, pour une séroprévalence de l’Ag HBs de 2%, si 100 sérums sont analysés dans 20 pools, 2 d’entre eux seront positifs. Il est donc nécessaire d’ajouter 10 déterminations (10 sérums retestés individuellement) aux 20 déterminations initiales (20 pools), ce qui donne 30 déterminations au total. Dans cet exemple, 70% du coût pourrait être économisé. Afin de réaliser une analyse coût-bénéfice, le prix du test HBsAg a été estimé à 3 dollars US pour chaque échantillon. Ceci étant basé sur le prix réel moyen du kit commercial dans notre hôpital.
Analyse statistique
Les données ont été recueillies dans une base de données et analysées ultérieurement à l’aide du progiciel statistique SPSS pour Windows, version 10.0. La corrélation linéaire non paramétrique de Spearman a été employée. Les résultats sont exprimés en moyenne ± SD. Un niveau de p < 0,05 a été considéré comme statistiquement significatif.
Résultats
Aucun des 50 pools de sérums négatifs pour l’AgHBs ne s’est révélé positif (S/N pool > 1), et les valeurs suivantes de S/N pool ont été obtenues : 0,767 ± 0,076 (intervalle 0,67-0,88). Avec cet échantillon, la spécificité de cette technique de pooling était donc de 100%. D’autre part, les 40 sérums positifs pour l’Ag HBs, lorsqu’ils ont été déterminés sous forme groupée, ont donné des valeurs S/N supérieures à 1 (la sensibilité étant également de 100 %). Le coefficient de corrélation entre les rapports S/N de ces 40 échantillons étudiés en simple et en pool était de 0,792 (p < 0,05).
Vingt-six virgule six pour cent des pools avec des échantillons ayant des titres élevés d’Ag HBs avaient un rapport S/N encore plus grand que l’échantillon simple. Cependant, le coefficient de corrélation des échantillons présentant de faibles titres d’Ag HBs (S/N unique < 25, n = 12) était excellent (R = 0,9739, p < 0,05), comme on peut le voir (Fig. 1).

La limite de détection en utilisant la méthode unique était de 0.34 ng/mL pour le sous-type ad et 0,29 ng/mL pour le sous-type ay, tandis que pour la méthode de regroupement, des niveaux plus faibles d’antigène ont été détectés : 0,20 ng/mL et 0,12 ng/mL, respectivement. Les résultats de l’application des techniques simple et groupée à des sérums présentant différentes concentrations d’AgHBs/ad et d’AgHBs/ay sont présentés (Fig. 2).

Lorsque le titre d’anti-HBs dans le pool est inférieur à 100 UI/L, la technique ne perd pas en sensibilité ; même lorsque les titres d’anti-HBs atteignent 10 000 UI/L, la technique est toujours capable de détecter des concentrations d’AgHBs aussi faibles que 1,5 ng/mL. L’influence des différentes concentrations d’anti-HBs sur la limite de détection des sous-types d’HBsAg lors de l’utilisation de la méthode de pooling sont présentées (moyenne de 2 déterminations) (Fig. 3).
Dans l’investigation réalisée en conditions réelles dans les sérums de femmes enceintes, la méthode de pooling a permis de classer correctement tous les échantillons analysés. Par conséquent, la sensibilité et la spécificité étaient de 100 %.
On constate une diminution du pourcentage de réduction du nombre de tests obtenus avec la méthode de pooling au fur et à mesure que la séroprévalence de l’Ag HBs augmente. On constate que même avec des prévalences d’Ag HBs aussi élevées que 10% dans l’échantillon étudié, une économie minimale d’au moins 30% est atteinte (Fig. 4).

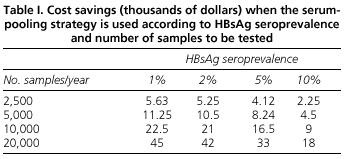
L’analyse des avantages économiques de la stratégie de mise en commun des sérums montre que les économies réalisées dépendent à la fois de la prévalence de l’Ag HBs et du nombre de déterminations à effectuer. Ainsi, pour les pays à faible prévalence comme le nôtre, la méthode de pooling permet de réduire le coût du dépistage de l’Ag HBs. Par exemple, nous avons estimé que pour 2 500 déterminations effectuées dans un laboratoire pendant une année en utilisant la méthode de pooling, l’économie sera de 5 630 dollars US, et dans le cas d’un hôpital très occupé effectuant 20 000 déterminations par an, l’économie atteindra 45 000 dollars US (tableau I).
Discussion
Une approche de la méthode de pooling consiste à maintenir la dilution et le volume final du mélange réactionnel dans chaque test groupé afin de ne pas perdre la sensibilité, pour laquelle le diluant est réduit, et partiellement remplacé par les sérums supplémentaires. De cette façon, il n’est pas nécessaire de modifier la valeur seuil par rapport à la méthode standard dans les échantillons individualisés. Cependant, la méthode utilisée dans notre étude était automatisée et la dilution des échantillons était effectuée par un auto-analyseur. Pour cette raison, chaque échantillon présente une dilution de 1 sur 5 lorsqu’il est mélangé avec les 4 autres sérums. Par conséquent, il a été nécessaire dans notre étude de modifier la valeur seuil et de limiter le nombre de sérums dans le pool afin de ne pas perdre en sensibilité.
En ce qui concerne la spécificité, il est nécessaire de remarquer que la valeur moyenne pour les pools n’était que légèrement supérieure à 3 écarts types du seuil. Ainsi, on peut s’attendre à un faux positif dans environ 1% des cas. Nous pensons que cela est acceptable car la spécificité est proche de 100% (99,9%). Une étude avec un plus grand nombre d’échantillons négatifs provenant d’un grand nombre d’individus différents sera nécessaire pour établir la véritable spécificité de ce test.
Bien que la corrélation entre les tests d’échantillons individuels et groupés soit bonne, la ligne de régression intercepte l’axe X à un rapport S/N de 3 (la valeur Y correspondante est 1). Cela peut signifier que tout échantillon ayant un rapport S/N entre 2 et 3 dans le test de l’échantillon unique aurait une valeur inférieure à 1 et ne serait donc pas détecté dans le test groupé.
Pour une prévalence de 1% de sérums positifs à l’Ag HBs, un modèle mathématique décrit par Liu et al. (19) a permis d’obtenir la réduction maximale (80,5%) du nombre de tests pour une taille de pool de 11 sérums. Cependant, selon nous, un problème de spécificité pourrait survenir en raison de l’effet du pooling sur le taux de faux positifs. Une augmentation des protéines non spécifiques, du fait du mélange des sérums, peut donner lieu à une augmentation de la couleur de fond. Avec la taille de pool de 5 choisie pour notre étude, et le changement de la valeur seuil de 2 à 1, aucune perte de sensibilité (faux négatifs) ou de spécificité (faux positifs) n’a été observée.
Les résultats de la présente étude montrent que la technique de pooling des sérums pour la détection de l’Ag HBs est hautement sensible et spécifique, et permet également des économies considérables. Ces résultats sont similaires à ceux obtenus par d’autres chercheurs qui ont appliqué la méthode du pooling à l’étude de l’infection par le VHC et le VIH (5-19). Jusqu’à présent, seules deux études (20,21) ont été rapportées concernant l’application de la méthode de pooling à l’étude de l’infection par le VHB. Dans l’une d’entre elles (20), réalisée lors d’un dépistage prénatal systématique de l’hépatite B en testant 10 pools d’échantillons, les auteurs ont trouvé une faible prévalence de porteurs chroniques (0,43%), et concluent qu’il s’agit d’une méthode rentable et d’une stratégie valable dans les zones de faible séroprévalence, avec une réduction de la sensibilité estimée à 4,2%. L’application dans notre étude de la méthode du pooling aux femmes enceintes, parmi lesquelles la prévalence des porteurs chroniques de l’AgHBs est de 0,93%, a démontré une sensibilité et une spécificité de 100%.
La distribution des deux principaux sous-types d’Ag HBs (ad et ay) dans notre environnement est d’environ 50% pour chacun d’eux, ay étant plus fréquent chez les toxicomanes qui utilisent la voie parentérale (22). Nous avons démontré que la méthode de pooling améliore la sensibilité, c’est-à-dire diminue la limite de détection d’un immuno-essai utilisé pour la détermination des deux principaux sous-types d’Ag HBs. Notre technique de pooling permet de détecter des quantités aussi faibles que 0,20 ng/mL de HBsAg/ad, et 0,12 ng/mL de HBsAg/ay, encore plus faibles que celles obtenues avec la méthode standard. La constatation d’une augmentation de la sensibilité avec le test groupé n’est pas surprenante, car d’autres auteurs l’ont déjà signalé (16). Il est important d’évaluer la sensibilité du kit EIA utilisé pour le test de pool, car tous les kits peuvent ne pas être adaptés au dépistage des pools, comme cela a été démontré dans le cas des anticorps contre le virus de l’hépatite C (23,24).
La présence d’anti-HBs dans les sérums de pool pourrait modifier la sensibilité de la technique, mais seulement de manière significative pour des titres supérieurs à 10 000 UI/mL, observés uniquement dans les échantillons des études de contrôle post-vaccination ; dans cette situation, la détermination de l’Ag HBs n’est pas indiquée. En fait, Cunninghan et al. (20) ont constaté que seulement 4,5 % des pools constitués de sérums de femmes enceintes présentaient un titre anti-HBs supérieur à 7 500 UI/L. En gardant à l’esprit cette limitation de la sensibilité de la méthode de pooling, ils ont constaté que la sensibilité et la spécificité étaient également d’environ 100 %. Nos résultats pourraient être reproductibles dans d’autres régions à faible prévalence, mais ils devraient être démontrés au préalable dans les régions à forte endémicité pour le VHB. Dans ces régions, la majorité de la population est déjà immunisée contre ce virus, et il est possible que les titres d’anti-HBs trouvés dans les sérums soient légèrement élevés.
Rabenau et al. (21) ont étudié la sécurité des tests sérologiques dans les pools de plasma pour l’HBsAg en utilisant un système EIA similaire au nôtre. Dans leur étude, la détection de l’Ag HBs était influencée par la présence de faibles titres d’anti-HBs après 5 heures d’incubation. Cependant, après la dissociation des complexes immuns, l’Ag HBs était encore détectable dans le pool même en présence d’un fort taux d’anti-HBs. Dans notre étude, nous démontrons que seule une diminution significative de la sensibilité résulte pour des titres d’anti-HBs supérieurs à 10 000 UI/L. Ces différences peuvent être dues au fait que, dans notre cas, les échantillons ont été testés sans incubation préalable. Cela pourrait empêcher la neutralisation de l’antigène par la formation d’immunocomplexes.
Nous pensons donc que, tant le titre d’anti-HBs dans le sérum que le traitement pré-test des échantillons avec l’EIA peuvent influencer la sensibilité de la méthode de pooling. Chaque laboratoire souhaitant utiliser cette technique devrait garder à l’esprit ces deux facteurs avant d’en généraliser l’utilisation.
L’OMS recommande l’utilisation de la méthode de pooling de sérums en cas d’infection par le VIH, lorsque la prévalence de la maladie est inférieure à 2%, et avec un pooling maximum de 5 sérums (25). Suivant ces indications, la plupart des études appliquent et recommandent l’utilisation des techniques de pooling dans les zones de faible séroprévalence. Dans notre étude, nous démontrons que le pooling de sérums peut également être rentable dans les populations ayant une prévalence élevée de porteurs de l’Ag HBs. Cela pourrait permettre son utilisation dans les pays appartenant aux zones d’endémicité moyenne et élevée pour l’infection par le VHB, ce qui coïncide en général avec les pays sous-développés ou en développement, c’est-à-dire ceux qui ont le plus besoin de réduire les coûts économiques liés aux tests de laboratoire. Néanmoins, il sera nécessaire de réaliser des études similaires dans ces régions afin de confirmer nos résultats. Cependant, il a déjà été démontré que dans des pays comme le Kenya, qui présente une fréquence élevée d’infection par le VIH (7,3 %), l’application du pooling pour sa détection permettrait une économie de 62 % sans perte significative de sécurité (14). En Espagne, pays appartenant à une zone de faible endémicité pour l’infection par le VHB, et avec une fréquence de porteurs de l’Ag HBs dans la population générale de 1,2% (4), il peut être utilisé dans tous les groupes dans lesquels le dépistage de l’Ag HBs est actuellement obligatoire (comme les donneurs de sang, les sujets soumis à des programmes d’autotransfusion, le dépistage des femmes enceintes).
L’étude coût-bénéfice de l’application des techniques de détection des porteurs chroniques du VHB permet de démontrer que les économies économiques sont plus importantes lorsqu’elles sont réalisées dans un grand nombre de déterminations dans des groupes à faible séroprévalence, et que son utilisation pourrait également être rentable dans les zones à forte prévalence d’infection, et même dans les laboratoires réalisant un petit nombre de déterminations. Nous avons montré des économies de coûts en fonction à la fois des différentes prévalences de l’Ag HBs et du nombre de tests à réaliser annuellement. Dans notre région, l’application de la méthode de regroupement pourrait permettre d’économiser environ 74% des coûts économiques totaux par rapport à la méthode unique.
Certains chercheurs ont récemment commencé à pratiquer des stratégies de détection des acides nucléiques viraux chez les donneurs de sang en utilisant la réaction en chaîne par polymérase (PCR) afin d’augmenter la sécurité impliquée dans la transfusion des dérivés du sang (26-29). Étant donné qu’il n’est pas possible d’effectuer des dépistages individuels en raison de problèmes économiques et de la quantité de travail que cela implique, la méthode consistant à regrouper des échantillons de sang sérologiquement négatif est maintenant utilisée. Cette procédure pourrait accroître la sécurité du sang grâce à un dépistage systématique des dons de sang à un coût relativement faible. Comme l’une des principales limites de la pratique de ces méthodes est d’ordre économique, nous pensons qu’avec notre étude, il pourrait y avoir une base théorique pour l’utilisation du dépistage des infections VHB, VHC et VIH en deux étapes à un coût économique relativement faible. Dans la première phase, un EIA commercial pourrait être appliqué à un pool de sérums de donneurs ; dans la seconde phase, l’application de techniques PCR à un pool d’échantillons séronégatifs pourrait augmenter la sécurité de l’analyse. Jusqu’à ce que de futures études puissent prouver la valeur de cette technique avec les donneurs de sang, nous pensons qu’elle ne pourrait être appliquée qu’aux tests diagnostiques et épidémiologiques.
Nous concluons que l’application de l’EIA à des sérums groupés est une méthode sensible et spécifique dans la détection des deux principaux sous-types d’Ag HBs dans une zone de faible séroprévalence. La sensibilité ne diminue que lorsque des titres très élevés d’anti-HBs existent dans les sérums groupés. La technique du pooling est une méthode qui peut également permettre des économies financières si elle est employée dans l’étude de populations ayant une prévalence élevée de porteurs de l’Ag HBs. Nous pensons que d’autres études sont nécessaires pour confirmer ces résultats.
Reconnaissances
Nous souhaitons remercier David H. Wallace (membre de l’Association européenne des rédacteurs scientifiques et du Council of Biological Editors) pour la traduction en anglais du manuscrit.
1. Maynard JE. Hépatite B : importance mondiale et nécessité de contrôle. Vaccine 1990 ; 8 (Supl.) : 18s-20s.
2. Margolis HS, Alter MJ, Hadler SC. Hépatite B : épidémiologie en évolution et implications pour le contrôle. Sem Liver Dis 1991 ; 11 : 84-92.
3. Alter MJ, Mast EE. L’épidémiologie de l’hépatite virale aux États-Unis. Gastroenterol Clin North Am 1994 ; 23 : 437-55.
4. Suárez A, Riestra S, Navascués CA, et al. Donneurs de sang positifs pour l’AgHBs dans les Asturies (Espagne) : prévalence actuelle et sa signification. (Résumé en anglais). Med Clin (Barcelona) 1994 ; 102 : 329-32.
5. Emmanuel JC, Basset MT, Smith HJ, Jacobs JA. Pooling of sera for human immunodeficiency virus (HIV) testing : an economical method for use in developing countries. J Clin Catholique 1988 ; 41 : 582-5.
6. Kline RL, Brothers TA, Brookmeyer R, et al. Evaluation de la séroprévalence du virus de l’immunodéficience humaine dans les enquêtes de population utilisant des sérums groupés. J Clin Microbiol 1989 ; 27 : 1449-52.
7. Cahoon-Young B, Chandler A, Livermore T, et al. Sensibilité et spécificité des sérums groupés par rapport aux sérums individuels dans une étude de prévalence des anticorps du virus de l’immunodéficience humaine. J Clin Microbiol 1989 ; 27 : 1893-5.
8. Frosner GG, Dobler G, von Sonnenburg FJ. Réduction des coûts des tests non liés pour l’anti-VIH par l’investigation de sérums groupés. AIDS 1990 ; 4 : 73-5.
9. Behets F, Bertozzi S, Kasali M, et al. Sucessful use of pooled sera to determine HIV-1 seroprevalence in Zaire with development of cost-efficiency models. AIDS 1990 ; 4 : 737-41.
10. Monzon OT, Paladin FJ, Dimaandal E, et al. Pertinence du contenu en anticorps et du format du test dans le dépistage du VIH sur des sérums groupés. AIDS 1992 ; 6 : 43-8.
11. Tamashiro H, Maskill W, Emmanuel J, et al. Reducing the cost of HIV antibody testing. Lancet 1993 ; 342 : 87-90.
12. Perriens JH, Magazani K, Kapila N, et al. Use of a rapid test and an ELISA for HIV antibody screening of pooled serum samples in Lubumbashi, Zaire. J Virol Methods 1993 ; 41 : 213-21.
13. McMahon EJ, Fang C, Layug L, Sandler SG. Mise en commun des échantillons des donneurs de sang pour réduire le coût du dépistage des anticorps du VIH-1. Vox Sang 1995 ; 68 : 215-9.
14. Verstraeten T, Farah B, Duchateau L, Matu R. Pooling sera to reduce the cost of HIV surveillance : a feasibility study in a rural Kenyan district. Trop Med Int Health 1998 ; 3 : 747-50.
15. Kamel MA, Ghaffar YA, Wasef MA, et al. High HCV prevalence in Egyptian blood donors. Lancet 1992 ; 340 : 427.
16. Neil AGS, Conradie JD. Low cost anti-HCV screening of blood donors. Lancet 1992 ; 340 : 1096.
17. Fernández E, Riestra S, García S, Rodríguez S. Tests de pool pour la détection de l’infection par le virus de l’hépatite C. J Hepatol 1995 ; 23 : 236.
18. García Z, Taylor L, Ruano A, et al. Evaluation d’une méthode de mise en commun pour le dépistage systématique de l’anti-HCV chez les donneurs de sang afin de réduire la charge financière des banques de sang dans les pays en développement. J Med Virol 1996 ; 49 : 218-22.
19. Liu P, Shi ZX, Zhang YC, et al. A prospective study of a serum-pooling strategy in screening blood donors for antibody to hepatitis C virus. Transfusion 1997 ; 37 : 732-6.
20. Cunningham R, Northwood JL, Kelly CD, et al. Routine antenatal screening for hepatitis B using pooled sera : validation and review of 10 years experience. J Clin Cathol 1998 ; 51 : 392-5.
21. Rabenau H, Schutz R, Berger A, et al. How accurate is serologic testing of plasma pools for hepatitis B virus surface antigen, anti-human immunodeficiency virus 1 and 2, and anti-hepatitis C virus ? (Résumé en anglais). Infus Transfus 1996 ; 23 : 124-30.
22. Echevarría JE, León P, López JA, et al. HBsAg subtype distribution among different populations of HBsAg carriers in Spain. Eur J Epidemiol 1995 ; 11 : 39-45.
23. Neill AGS, Conradie JD. Tests de pool pour le virus de l’hépatite C. Lancet 1994 ; 343 : 738.
24. Liu P, Shi ZX, Zhang YC, Zhang XY. Comparative study on 4 EIA kits for screening antibody to hepatitis C virus in pooled sera. Biomed Environ Sci 1998 ; 11 : 75-80.
25. Recommandations pour le dépistage des anticorps anti-VIH sur pool de sérum. WHO Weekly Epidemiol Rec 1991 ; 44 : 316-27.
26. Lefrere JJ, Coste J, Defer C, et al. Screening blood donations for viral genomes : multicenter study of real-time simulation using pooled samples on the model of hepatitis C virus RNA detection. Transfusion 1998 ; 38 : 915-23.
27. Yerly S, Pedrocchi M, Perrin L. L’utilisation de la réaction en chaîne par polymérase dans des pools de plasma pour la détection concomitante du virus de l’hépatite C et de l’ARN du VIH de type 1. Transfusion 1998 ; 38 : 908-14.
28. Schottstedt V, Tuma W, Bunger G, Lefevre H. PCR for HBV, HCV and HIV-1 experiences and first results from a routine screening programme in a large blood transfusion service. Biologicals 1998 ; 26 : 101-4.
29. Morandi PA, Schockmel GA, Yerly S, et al. Détection de l’ARN du virus de l’immunodéficience humaine de type 1 (VIH-1) dans des pools de sérums négatifs pour les anticorps du VIH-1 et du VIH-2. J Clin Microbiol 1998 ; 36 : 1534-8.
Laisser un commentaire