Dans la réaction avec l’ammoniac, pourquoi l’eau est-elle l’acide?
C’est une grande réaction de chimie générale avec des implications importantes en chimie organique. Une autre question similaire est : pourquoi l’eau est-elle une base lorsqu’elle réagit avec un « acide » ? La réponse à ces deux questions est la suivante : tout est relatif ! Ici, à StudyOrgo, nous recevons fréquemment des questions de ce type sur des sujets de chimie organique qui sont généralement traités rapidement, mal décrits ou que vous connaissez déjà grâce à vos cours précédents. Ces concepts sont très importants pour comprendre les sujets plus complexes à venir. Avec une adhésion à StudyOrgo, vous obtiendrez encore plus de conseils et d’astuces sur des sujets de chimie organique et des mécanismes détaillés avec des explications. Le blog d’aujourd’hui est un aperçu des sujets détaillés et du matériel disponible. Découvrez une adhésion à StudyOrgo.com et inscrivez-vous dès aujourd’hui !
Rappellez-vous qu’en termes d’acides et de bases, il existe deux définitions ; la définition de Bronsted et celle de Lewis. Les acides de Bronsted sont définis comme donneurs de protons, tandis que les acides de Lewis sont définis comme accepteurs d’électrons. Les deux sont des acides, mais ce qui nous différencie, c’est le fait que des protons ou des électrons soient impliqués. Dans une solution aqueuse, en chimie générale ou en biochimie, nous pensons principalement à la définition de Bronsted parce que la dissociation des protons des acides modifie la concentration de H+ dans la solution, ce que nous interprétons comme une modification du pH et de l' »acidité » de la solution. Nous mesurons la dissociation des protons des acides, ou l’acceptation des protons par les bases, par une valeur numérique qui est le pKa. Plus le pKa est élevé, plus l’acide est faible et la base forte. Plus le pKa est faible, plus l’acide est fort et la base faible. Une astuce simple pour penser au pKa consiste à placer la version protonée de la molécule à gauche et à la considérer comme un donneur de protons. Le pKa vous indique à quel point ce don sera facile, plus le chiffre est bas, plus le don de proton est facile.
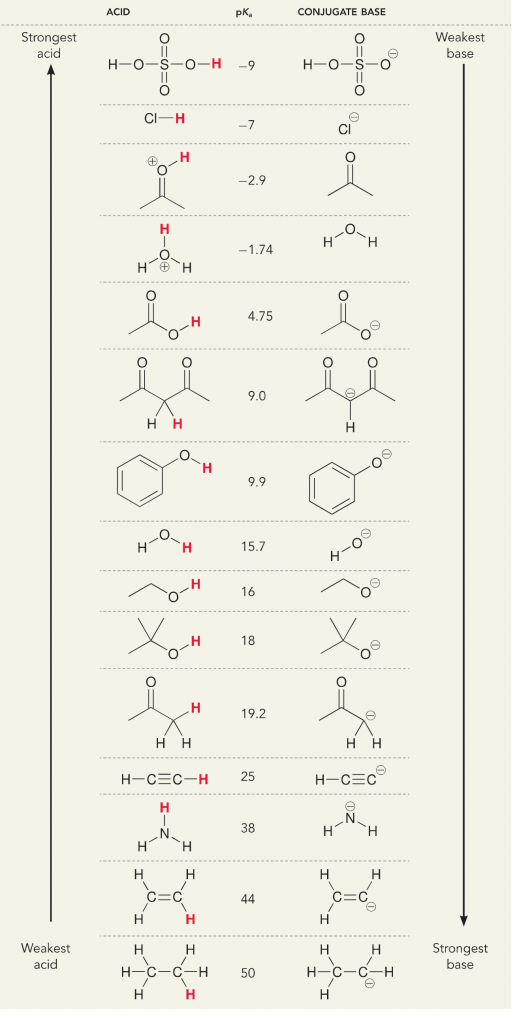
Regardons la réaction de l’ammoniac et de l’eau ; le pKa de l’eau est défini comme 14. Le pKa de l’ammoniac est de ~37.
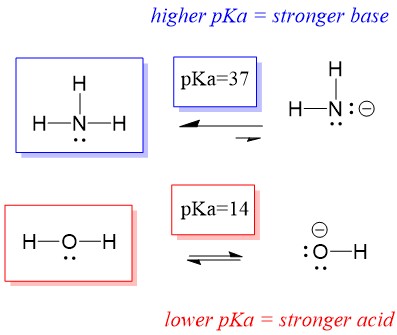
Donc, comme le pKa de l’eau est inférieur à celui de l’ammoniac, c’est un acide plus fort l’ammoniac et il donnera des protons à la base ammoniacale. Cette réaction conduit l’eau à devenir la base conjuguée OH- et l’ammoniac à devenir l’acide conjugué NH4+. Il est intéressant de noter que c’est la raison pour laquelle l’ammoniac est un agent caustique, il produit de l’hydroxyde qui réagit avec les taches et les micro-organismes pour nettoyer et assainir efficacement les articles ménagers.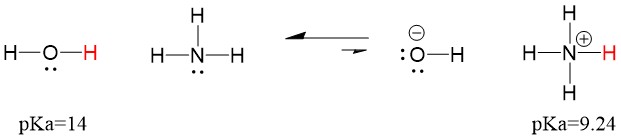
Ceci est important en tant que concept de chimie organique parce que la force des acides et des bases en termes d’électrons, ou la définition de Lewis, est exactement la façon dont nous pensons aux mécanismes de rupture et de formation des liaisons ; le flux d’électrons. La force des acides de Lewis et de l’acide conjugué peut aider à identifier la direction que prendra une réaction. Nous pouvons voir que la réaction de l’eau un ammoniac est défavorable, mais suffisamment de la réaction se produit dans la réalité pour réduire significativement le pH de l’eau (pH~11 avec l’ammoniac).
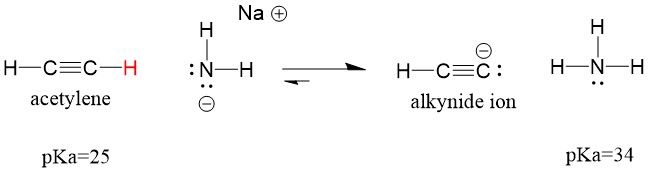
Regardons un acétylène réagissant avec une base pour générer un ion alcynide, un nucléophile utile pour la formation de la liaison C-C. Si nous essayons de faire réagir l’hydroxyde de sodium avec l’alcyne, l’ion alcynide NE SERA PAS formé. Cela est dû au fait que le produit acide conjugué de la réaction, l’eau, qui a un pKa de 15, est PLUS FORT que l’acétylène acide d’origine (pKa = 25). Les réactions favorisent TOUJOURS la formation de l’acide le plus faible, ou dans ce cas, le côté réactif.
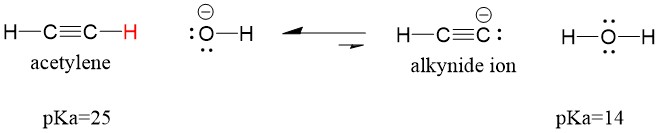
Si nous changeons notre base en amide de sodium, qui est une base beaucoup plus forte, l’ion alcynide sera formé. Cela est dû au fait que le produit acide conjugué de la réaction est l’ammoniac, qui a un pKa de 38, et qui est un acide conjugué plus FAIBLE que l’acétylène acide initial (pKa = 25). Dans ce cas, la réaction favorise le côté produit!
 .
.
Laisser un commentaire