- Qu’est-ce que le fer
- Où trouve-t-on le fer
- Histoire
- Identification
- Classification, Propriétés et caractéristiques du fer
- Propriétés générales
- Propriétés physiques
- Propriétés chimiques
- Données atomiques du fer (élément 26)
- Quelles sont les utilisations courantes du fer
- L’élément a-t-il des effets toxiques
- Faits intéressants
- Prix du métal de fer
Qu’est-ce que le fer
Le fer (pronominé EYE-ren) est un métal dur à forte valeur commerciale, appartenant à la famille des métaux de transition. Représenté par le symbole chimique Fe, il est chimiquement réactif et a tendance à se corroder facilement à l’air en formant une couche rougeâtre appelée rouille lorsqu’il est exposé à l’air humide .

Symbole du fer
Où trouve-t-on le fer
C’est le quatrième métal le plus abondant dans la croûte terrestre, communément associé à d’autres minerais comme l’hématite, la taconite et la magnétite que l’on trouve dans les réserves minières d’Ukraine, du Brésil, de Russie, d’Australie et de Chine. Sa production commerciale s’effectue dans un haut fourneau en chauffant les minerais avec du coke et du calcaire .
Histoire
Origine de son nom : Le nom de l’élément vient d’un mot anglo-saxon « iron ».
Qui l’a découvert : Inconnu
Quand, où et comment a-t-il été découvert
Vers 3500 avant JC, les Égyptiens auraient utilisé des objets en fer. Les Hittites d’Asie Mineure étaient connus pour fondre le métal à partir de ses minerais vers 1500 av. En 1722, René Antoine Ferchault de Réaumur, un entomologiste français a publié un livre, décrivant la signification des différents alliages de fer .

Fer métal
Identification |
|||
| Numéro atomique | 26 | ||
| Numéro CAS | 7439-89-.6 | ||
| Position dans le tableau périodique | Groupe | Période | Bloc |
| 8 | 4 | d | |
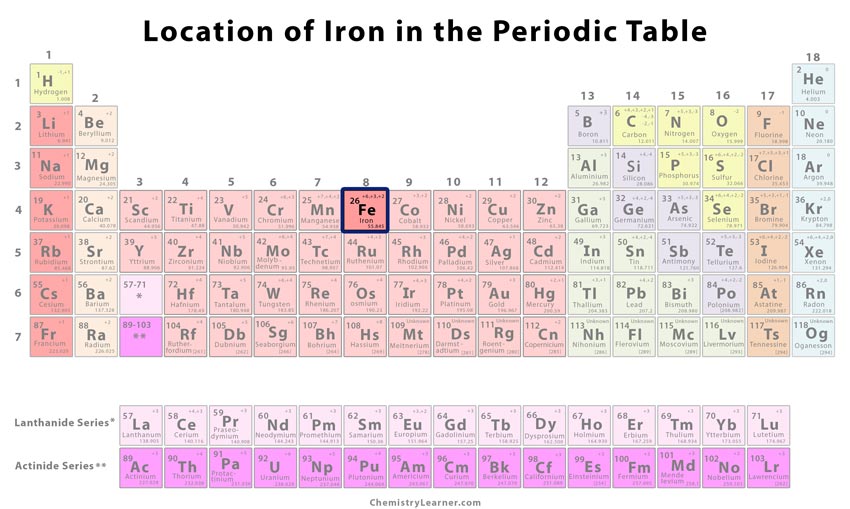
Où se situe le fer dans le tableau périodique
Classification, Propriétés et caractéristiques du fer
Propriétés générales |
||
| Masse atomique relative | 55.845 | |
| Masse atomique/poids | 55,845 unités de masse atomique | |
| Masse molaire/poids moléculaire | 55.845 g/mole | |
| Nombre de masse | 56 | |
Propriétés physiques |
||
| Couleur/aspect physique | gris argenté | |
| Point de fusion/point de congélation | 1538°C (2800°F) | |
| Point d’ébullition | 2861°C (5182°F) | |
| Densité | 7.87 g/cm3 | |
| État standard/naturel à température ambiante (solide/liquide/gaz) | Solide | |
| Malléabilité | Oui | |
| Ductilité | Oui | |
| Dureté | 4-.5 Mohs | |
| Capacité thermique spécifique | 0.444 J g-1 oC | |
| Conductivité thermique | 80.4 Wm-1K-1 | |
Propriétés chimiques |
||
| Inflammabilité | Ininflammable | |
| États d’oxydation (nombres) | 6, 3, 2, 0,-2 | |
Données atomiques du fer (élément 26)
| Configuration des électrons (configuration des gaz rares) | 3d64s2 | ||||||
| Structure atomique | |||||||
| -. Nombre d’électrons | 26 | ||||||
| – Nombre de neutrons | 30 | ||||||
| – Nombre de protons | 26 | ||||||
| Radius de l’atome | |||||||
| – Rayon atomique | 2.04 Å | ||||||
| – Rayon covalent | 1.24 Å | ||||||
| – Énergie d’ionisation
(kJmol-1) |
1e | 2e | 3e | 4e | 5e | 6e | 7e |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
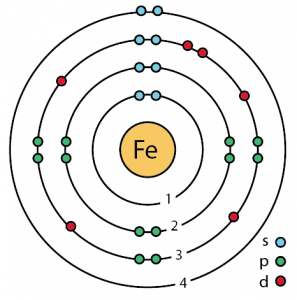
Structure atomique du fer (modèle de Bohr)
Quelles sont les utilisations courantes du fer
- Le fer est utilisé dans la fabrication de différents types d’acier en s’alliant à d’autres éléments comme le carbone, le nickel, le chrome et le tungstène pour fabriquer du matériel de coupe, des chaînes de bicyclette, des canons de fusil, des tours de transmission, des poutres de pont et du béton armé .
- L’acier inoxydable contenant un pourcentage élevé de fer avec d’autres métaux a une énorme résistance et une meilleure fonction qui est utile dans la fabrication d’instruments chirurgicaux, de trombones, de coutellerie, de roulements à billes et de bijoux .
- Une autre forme de Fe appelée fer forgé obtenue par fusion est utilisée pour fabriquer des outils de charpentier, des crochets de levage, des chaînes, des clôtures et des portes .
- Les remplissages en fer sont applicables dans les expériences scientifiques d’électromagnétisme pour évaluer la force des aimants ainsi que dans la métallurgie de puissance, les œuvres d’art, les feux d’artifice et le sablage .
- Le Fe agit comme un catalyseur efficace est certains processus chimiques industriels tels que le processus Haber et Fischer-Tropsch .

Barre de fer
L’élément a-t-il des effets toxiques
L’ingestion accidentelle de Fe a été associée à des vomissements, des diarrhées et d’autres problèmes gastro-intestinaux, un type courant d’empoisonnement aux métaux. Une accumulation prolongée dans le corps pourrait entraîner des problèmes respiratoires et des troubles cardiaques . L’inhalation de la poussière ou des fumées de métal peut provoquer une réaction pulmonaire grave .
Faits intéressants
- Les météorites auraient une forte teneur en fer .
- Le fer était utilisé comme métal magnétique par les navigateurs de l’Antiquité sous la forme de pierres de loges pour fabriquer des boussoles .
- Dans un corps humain moyen, 4 grammes de Fe sont présents, associés à l’hémoglobine qui, à son tour, aide à transporter l’oxygène vers les poumons .
-

Poudre de fer
Prix du métal de fer
Le coût du fer pur peut varier entre 0,24 et 0,30 $ la livre.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Laisser un commentaire