Rapport de cas
Clinical Findings
Une femme de 65 ans a présenté de multiples nodules discrets asymptomatiques et des plaques atrophiques sur les cuisses depuis 4 ans. Les lésions avaient commencé par 2 petites plaques asymptomatiques rouge garance situées symétriquement sur la face antérieure de chaque cuisse qui avaient progressivement augmenté en nombre et en taille, notamment sur la cuisse droite. Deux ans plus tard, 2 nouvelles plaques atrophiques sont apparues sur la face antérieure de chacune. Les lésions se sont développées lentement mais n’ont jamais régressé et avaient été diagnostiquées à tort comme une atrophie maculaire primaire de la peau par plusieurs cliniques externes. L’examen physique a révélé de multiples plaques et nodules rouge garance de formes et de tailles diverses (c’est-à-dire de 1 à 3 cm de diamètre) sur la face antérieure de la cuisse droite. Les lésions étaient légèrement surélevées avec une surface cireuse, fermes et indolores à la palpation. Une lésion similaire a été notée sur la face antérieure de la cuisse gauche. Deux plaques atrophiques de 2 cm, de couleur brun-rouge, ont également été observées dans une distribution symétrique sur la face antérieure de chaque cuisse. La surface des plaques était légèrement fripée et brillante, et les lésions anétodermiques produisaient à la palpation un signe de boutonnière identique à celui d’un neurofibrome (figure 1).
 Figure 1. De multiples plaques, nodules et plaques atrophiques rouge garance de formes et de tailles diverses ont été observées sur la face antérieure des deux cuisses.
Figure 1. De multiples plaques, nodules et plaques atrophiques rouge garance de formes et de tailles diverses ont été observées sur la face antérieure des deux cuisses. Regardes histopathologiques
Deux échantillons de biopsie ont été prélevés sur un nodule et une plaque atrophique sur la cuisse droite. L’examen microscopique a révélé un dépôt de matériel éosinophile homogène dans le derme réticulaire et le sous-cutané ainsi qu’autour des vaisseaux fins (figure 2A). Il y avait une légère infiltration cellulaire de lymphocytes, de plasmocytes et de cellules géantes dans le derme, surtout à proximité des dépôts et autour des vaisseaux (Figure 2B). Le matériau homogène est apparu rose saumoné à la coloration rouge Congo et vert vif à la coloration thioflavine T au microscope à fluorescence (Figures 3 et 4). Ces résultats suggéraient les traits caractéristiques d’une amylose nodulaire cutanée.
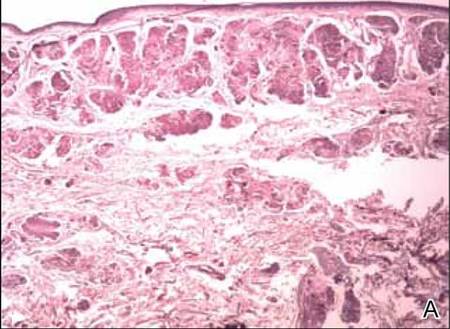
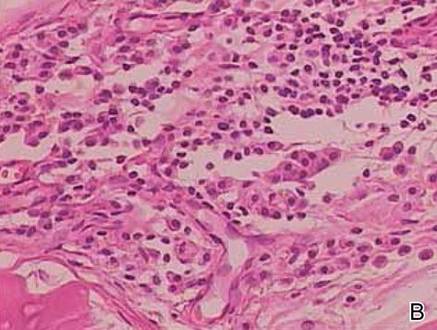
Figure 2. Histopathologiquement, on a noté un matériel éosinophile homogène déposé dans le derme réticulaire et le sous-cutané (A)(H&E, grossissement original ×25). L’examen microscopique a montré des lymphocytes et des plasmocytes infiltrés dans le derme, notamment au voisinage des dépôts et autour des vaisseaux (B)(H&E, grossissement original ×200).
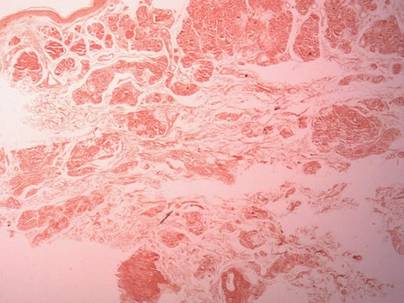
Figure 3. La coloration au rouge Congo a montré un matériau homogène rose saumon (grossissement original ×25).
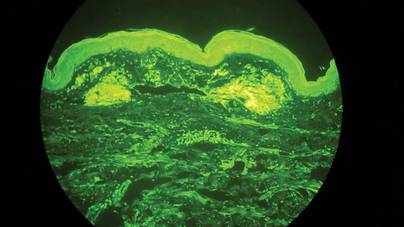
Figure 4. La coloration à la thioflavine T a montré un matériau homogène vert brillant (grossissement original ×100).
Résultats de laboratoire
Les études de laboratoire ont montré des résultats normaux pour la numération globulaire complète, l’analyse d’urine, les tests de fonction hépatique et rénale, la glycémie, le panel lipidique et la vitesse de sédimentation des érythrocytes. L’électrophorèse des protéines sériques était normale et aucune protéine de Bence Jones n’a été détectée. Les taux sériques d’IgA, d’IgG et d’IgM ne présentaient aucune anomalie. L’électrocardiogramme, la radiographie pulmonaire et l’échographie abdominale étaient normaux.
Un diagnostic d’amylose nodulaire cutanée localisée primaire (PLCNA) a été posé sur la base des résultats cliniques, histopathologiques et de laboratoire. Bien qu’une excision chirurgicale par étapes ait été proposée, le patient a refusé le traitement car les lésions étaient asymptomatiques. Il n’y a pas eu de progression évidente des lésions cutanées et aucun résultat systémique anormal au cours des 2,5 années de suivi.
Commentaire
L’amylose est un spectre de maladies consistant en un dépôt de protéines amyloïdes dans divers tissus. Cliniquement, l’amylose est divisée en formes primaires et secondaires d’amylose systémique, d’amylose associée à l’hémodialyse, d’amylose héréditaire et d’amylose cutanée. L’amylose cutanée primaire est localisée à la peau sans atteinte d’autres organes et ne se produit pas dans l’amylose systémique. L’atteinte cutanée secondaire dans l’amyloïdose systémique est rare. La plupart des cas d’amylose cutanée localisée primaire (ACLP) sont sporadiques mais environ 10 % des cas peuvent être familiaux.1 Il existe 3 formes principales d’amylose cutanée localisée : l’amylose maculaire, l’amylose lichénique et l’amylose nodulaire. L’amylose cutanée nodulaire est la forme la plus rare d’APLC.
L’amylose nodulaire a été décrite pour la première fois par Gottron en 1950.2 Ses lésions cutanées peuvent se présenter sous la forme de nodules uniques ou multiples, avec parfois des plaques atrophiques sus-jacentes. Les lésions consistent en des papules, plaques ou nodules fermes, à surface lisse, cireuses ou caoutchouteuses, de couleur rose à havane, mesurant jusqu’à plusieurs centimètres. Sur certaines lésions, on peut observer une télangiectasie de surface. Des lésions d’aspect bulleux et anétodermique ont été signalées.3 La région acrale est la localisation la plus courante, suivie par les jambes, la tête, le tronc, les bras et les organes génitaux, respectivement.4 Dans certains cas, les lésions peuvent s’améliorer spontanément avec le temps. Chez notre patient, les lésions étaient composées à la fois de nodules multiples et de plaques atrophiques, ce qui est peu fréquent.
La pathogénie du dépôt amyloïde est encore inconnue. L’amylose maculaire et lichénique cutanée pourrait provenir de filaments intermédiaires kératinocytaires dégénérés. L’amylose nodulaire peut représenter une dyscrasie plasmocytaire localisée qui peut être associée à une gammopathie monoclonale ou à un myélome multiple.5 Dans certains cas de PLCNA, certains composants de l’amylose peuvent être constitués de chaînes légères d’immunoglobulines κ et λ, la plupart des cas rapportés étant du sous-type l.6 Les résultats d’une étude ont indiqué que la β2-microglobuline était un autre composant majeur des fibrilles amyloïdes et que la β2-microglobuline était en partie soumise à la modification du produit final de glycation avancée dans le PLCNA.7
.
Laisser un commentaire