Les éléments du groupe 13 comprennent les métaux post-transition.
Le terme métaux post-transition désigne les éléments qui sont des métaux après les métaux de transition. Comme pour le concept de métalloïde, il n’y a pas de consensus universel sur ce qu’est exactement un métal post-transition. Heureusement, dans la pratique, il est moins important de définir précisément ce qui est et n’est pas un métal post-transition que de comprendre la raison pour laquelle il pourrait être utile de classer les éléments comme un métal post-transition.
Les principales caractéristiques des métaux de post-transition sont qu’ils sont relativement riches en électrons et électronégatifs par rapport à ce que l’on considère classiquement comme un métal. En gros, cela se traduit par des points de fusion relativement plus bas (puisque davantage de niveaux anti-bondage dans la structure de bande ont tendance à être occupés), une préférence accrue pour la covalence et une plus grande fragilité que les autres métaux (en raison de la liaison directionnelle qui en résulte). Leur richesse en électrons signifie qu’ils ont tendance à former des cations mous.
Plusieurs systèmes sont utilisés pour classer les éléments comme appartenant aux métaux post-transition. Les principaux comprennent :
- Les métaux qui suivent le bloc d. Selon cette définition, seuls sont inclus les métaux des groupes 13 et plus et des rangs 3 et plus qui forment des cations relativement mous et riches en électrons et présentent une covalence importante dans leur liaison. Cependant, si ce schéma est adopté de manière trop rigide, l’Al est exclu car il ne suit pas techniquement le bloc d (et possède une sous-coquille (n-1)d non remplie) et les métalloïdes sont exclus, même si beaucoup d’entre eux forment également des cations relativement mous et riches en électrons avec des sous-coquilles (n-1)d remplies. Un autre inconvénient de ce système est qu’il enchevêtre la question de savoir quels éléments doivent être classés comme métaux post-transition avec la question épineuse de savoir quels éléments doivent être classés comme métaux par rapport aux métalloïdes.
- Métaux et métalloïdes du bloc p. Ce système a l’avantage de mettre l’accent sur les propriétés intéressantes et uniques des métaux et des métalloïdes du bloc p ainsi que sur les continuités de ces propriétés à travers le bloc p. Par conséquent, il sera utilisé dans les sections qui suivent. Cependant, elle a l’inconvénient d’exclure des métaux comme Zn, Cd et Hg, qui forment de nombreux composés dans lesquels le métal a une configuration (n-1)d10.
- Les métaux qui suivent les éléments de transition dans le sens de la formation d’ions avec une coquille de valence (n-1)d complètement complète, parfois avec Al et les métalloïdes du bloc p. Cette définition ajoute le Zn, le Cd et le Hg (et parfois le Cu, l’Ag et l’Au) puisqu’ils forment des ions avec une configuration d’électrons de valence (n-1)d 10 tels que Zn2+, Cd2+ et Hg2+ (et Cu+, Ag+ et Au+). Puisque ce chapitre ne considère que les éléments du bloc p pour les besoins de ce chapitre, ce système est fonctionnellement identique au système 2.
Quel que soit le schéma de classification utilisé, il est souvent plus utile de penser à la classification des éléments en tant que métaux de post-transition comme un moyen de souligner les similitudes dans les propriétés chimiques d’un ensemble d’éléments que comme un moyen de souligner comment les métaux de post-transition diffèrent des autres métaux. Les métaux post-transition ne sont pas les seuls à former des cations mous ou des composés mieux décrits comme étant liés par des liaisons covalentes. Comme les sections précédentes l’ont clairement montré, même les métaux alcalins forment des anions dans des circonstances appropriées et de nombreux composés de métaux sont mieux décrits en termes de covalence que d’interactions ioniques. Cela était déjà évident dans la chimie des métaux alcalino-terreux Be et Mg examinés dans la section précédente. Dans les chapitres suivants, la liaison et la réactivité dans les complexes de coordination et les composés organométalliques seront largement décrites en termes covalents.
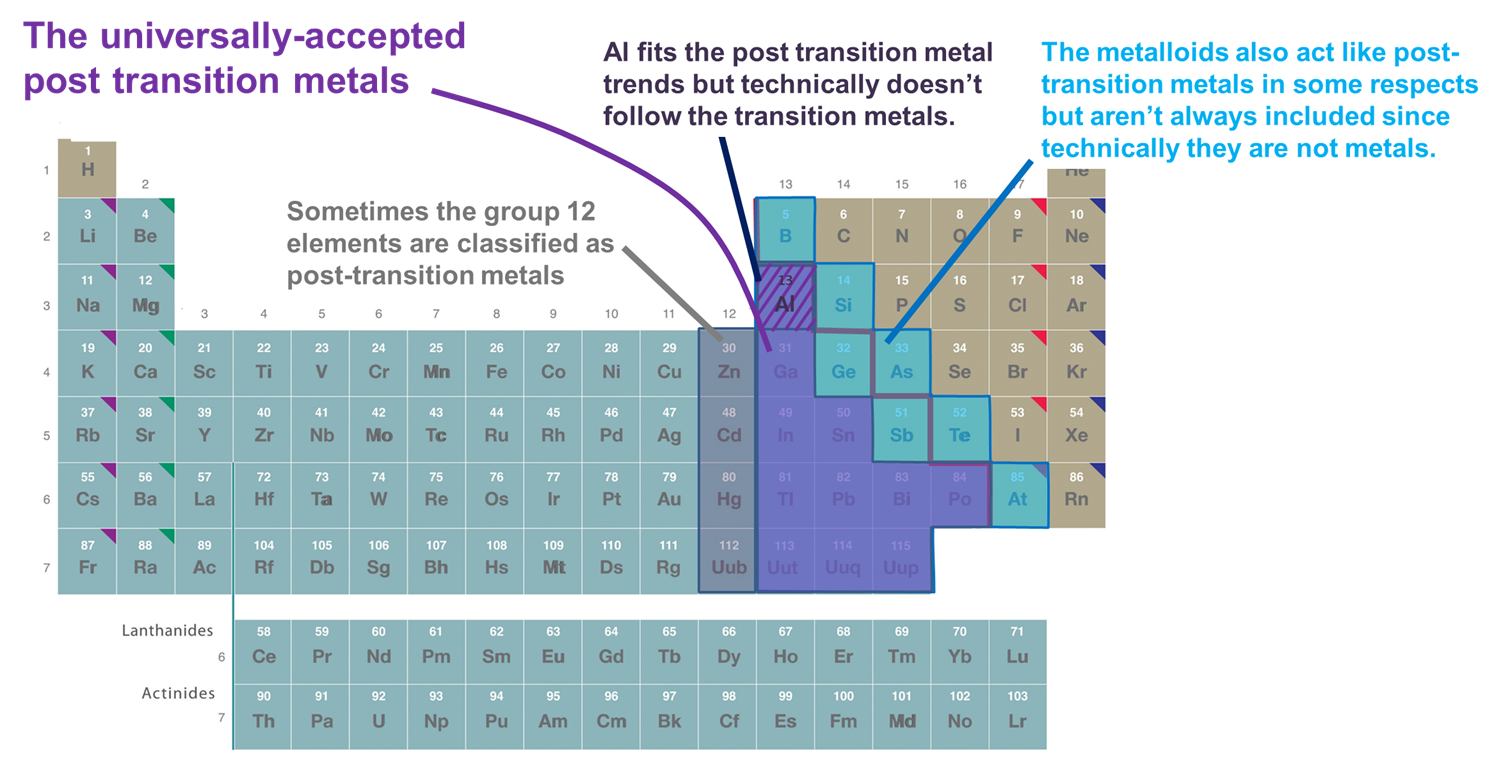
Figure \(\sf{\PageIndex{2}}\). Quelques-uns des éléments classés comme métaux de post-transition. Ceux qui sont représentés en violet sont communément acceptés car ce sont des métaux et ils suivent clairement les métaux de transition, tandis que les métaux des groupes 12 (et parfois 11), Al, et les métalloïdes sont tous parfois inclus car ils se comportent comme les autres métaux post-transition à des égards importants. Le tableau périodique est adapté de celui de https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molécules%2C_et_Ions/2.5%3A_The_Periodic_Table.
.
Laisser un commentaire