Moments dipolaires moléculaires
Dans les molécules contenant plus d’une liaison polaire, le moment dipolaire moléculaire est juste la combinaison vectorielle de ce qui peut être considéré comme des « moments dipolaires de liaison » individuels. Mathématiquement, les moments dipolaires sont des vecteurs ; ils possèdent à la fois une magnitude et une direction. Le moment dipolaire d’une molécule est donc la somme vectorielle des moments dipolaires des différentes liaisons de la molécule. Si les moments dipolaires des liaisons individuelles s’annulent, il n’y a pas de moment dipolaire net. C’est le cas du CO2, une molécule linéaire (Figure \(\PageIndex{1a}\)). Chaque liaison C-O du CO2 est polaire, mais les expériences montrent que la molécule de CO2 n’a pas de moment dipolaire. Comme les deux dipôles des liaisons C-O du CO2 sont de même amplitude et orientés à 180° l’un par rapport à l’autre, ils s’annulent. Par conséquent, la molécule de CO2 n’a pas de moment dipolaire net, même si elle présente une séparation substantielle des charges. En revanche, la molécule de H2O n’est pas linéaire (Figure \(\PageIndex{1b}\)) ; elle est courbée dans l’espace tridimensionnel, de sorte que les moments dipolaires ne s’annulent pas. Ainsi, une molécule telle que H2O possède un moment dipolaire net. On s’attend à ce que la concentration de la charge négative se trouve sur l’oxygène, l’atome le plus électronégatif, et la charge positive sur les deux hydrogènes. Cette polarisation de la charge permet à H2O de se lier par hydrogène à d’autres espèces polarisées ou chargées, y compris d’autres molécules d’eau.
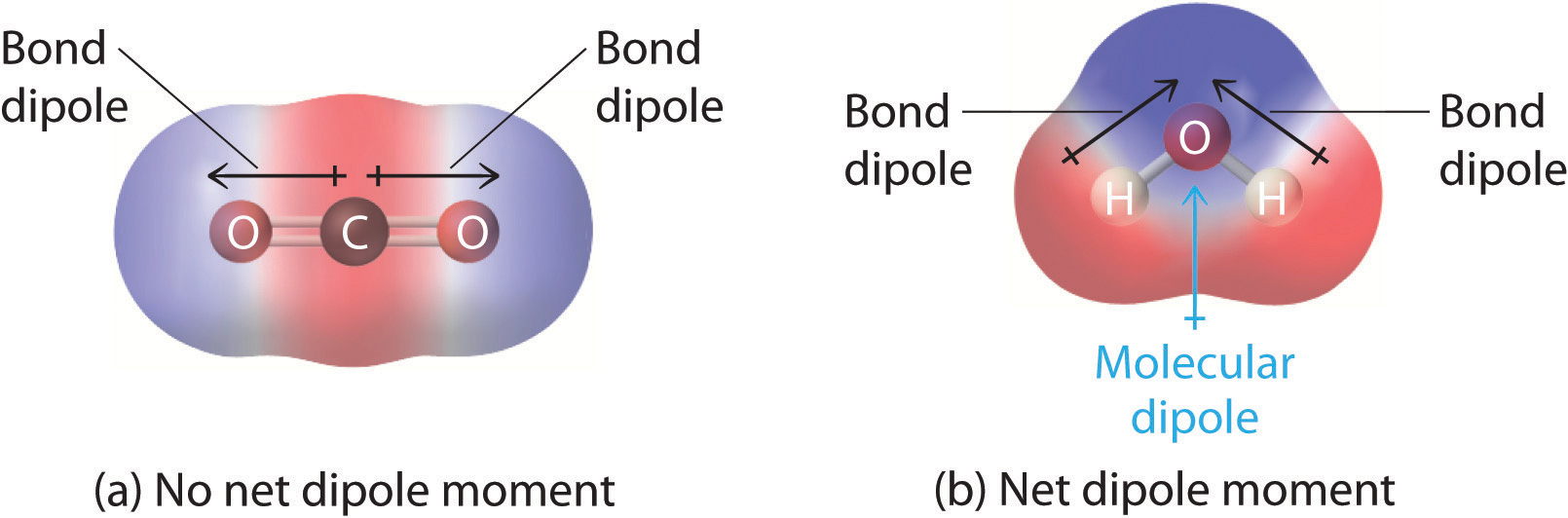
Figure \(\PageIndex{1}\) : Comment les moments dipolaires de liaison individuels sont additionnés pour donner un moment dipolaire moléculaire global pour deux molécules triatomiques de structures différentes. (a) Dans le CO2, les dipôles de la liaison C-O sont de même grandeur mais orientés dans des directions opposées (à 180°). Leur somme vectorielle est nulle, le CO2 n’a donc pas de dipôle net. (b) Dans H2O, les dipôles de la liaison O-H sont également égaux en magnitude, mais ils sont orientés à 104,5° l’un par rapport à l’autre. Par conséquent, la somme vectorielle n’est pas nulle, et H2O a un moment dipolaire net.
Ce qui suit est une équation simplifiée pour un système simple à deux charges séparées qui est présent dans les molécules diatomiques ou lorsqu’on considère un dipôle de liaison dans une molécule.
\
Ce dipôle de liaison, µ (grec mu) est interprété comme le dipôle provenant d’une séparation de charges sur une distance \(r\) entre les charges partielles \(Q^+\) et \(Q^-\) (ou les termes plus couramment utilisés \(δ^+\) – \(δ^-\)) ; l’orientation du dipôle est le long de l’axe de la liaison. Les unités des moments dipolaires sont généralement des debyes (D), où un debye est égal à 3,336 x 1030 mètres coulomb (C – m) en unités SI. Considérons un système simple composé d’un électron et d’un proton séparés par une distance fixe. La charge unitaire d’un électron est de 1,60 X 1019 C et le proton & est séparé de 100 pm (environ la longueur d’une liaison covalente typique), le moment dipolaire est calculé comme suit :
\ &= (1,60 \times 10^{-19}\, C)(1,00 \times 10^{-10} \,m) \nonumber \\\ &= 1,60 \times 10^{-29} \,C \cdot m \label{2} \end{align}\]
\ &= 4.80\ ; D \label{3} \end{align}\]
\(4,80\ ; D\) est une valeur de référence clé et représente une charge pure de +1 et -1 séparée par 100 pm. Cependant, si la séparation des charges était augmentée alors le moment dipolaire augmente (linéairement) :
- Si le proton et l’électron étaient séparés de 120 pm :
\
- Si le proton et l’électron étaient séparés de 150 pm:
\
- Si le proton et l’électron étaient séparés de 200 pm:
\
Exemple \(\PageIndex{1}\) : Eau
La molécule d’eau de la figure \(\PageIndex{1}\) peut être utilisée pour déterminer la direction et la magnitude du moment dipolaire. D’après les électronégativités de l’oxygène et de l’hydrogène, la différence est de 1,2e pour chacune des liaisons hydrogène-oxygène. Ensuite, l’oxygène étant l’atome le plus électronégatif, il exerce une plus grande attraction sur les électrons partagés ; il possède également deux paires d’électrons solitaires. On peut donc en conclure que le moment dipolaire se situe entre les deux atomes d’hydrogène et l’atome d’oxygène. À l’aide de l’équation ci-dessus, on calcule que le moment dipolaire est de 1,85 D en multipliant la distance entre les atomes d’oxygène et d’hydrogène par la différence de charge entre eux, puis en trouvant les composantes de chacun qui pointent dans la direction du moment dipolaire net (l’angle de la molécule est de 104.5˚).
Le moment de liaison de la liaison O-H =1,5 D, donc le moment dipolaire net est
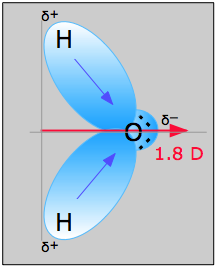
.
Laisser un commentaire