Ben Valsler
All that glitters is not gold,
often have you heard that told that.
Brian Clegg shows another side,
to fools gold – iron sulfide.
Brian Clegg
’There’s gold in them thar hills!’ Vai onko siellä? Kuten lempinimensä hölmöjen kulta antaa ymmärtää, rauta II-disulfidin pyriittimineraalimuodolla on enemmän kuin ohimenevä yhdennäköisyys jalometallin kanssa. Yhdisteen yksinkertainen kaava on FeS2, ja sen kuutiorakenne voi tuottaa huomattavan tehokkaan näköisiä platonisia muotoja sekä teräväkulmaisina kuutioina että dodekaedreina, jotka näyttävät ikään kuin valmistetuilta, vaikkakin luonnollisessa muodostumisessa syntyy useammin vähemmän selvästi erottuva rakenne.

Lähde: ©
Rautadisulfidin kiteissä rikkiatomit esiintyvät pareittain, jolloin yksi rikin neljästä sidoksesta liittyy toiseen rikkiatomiin. Nämä sidokset katkeavat kuumennettaessa, jolloin syntyy rauta-II-sulfidia – FeS – ja rikkiä. Tätä prosessia käytetään rikkidioksidin tuotannossa sekä kaasun käyttämiseksi esimerkiksi paperin valkaisuaineena että rikkihapon valmistuksen ensimmäisenä vaiheena. Viime aikoina yhdisteelle, joka on puolijohde, on löytynyt käyttöä litium-rautaparistoissa, joissa katodi on tehty rautadisulfidista: nämä paristot ovat jännitteeltään yhteensopivia perinteisten 1,5 voltin kennojen kanssa, mutta kestävät huomattavasti pidempään kuin alkaliparistot.

Lähde: ©
Rautadisulfidin ehkä varhaisin käyttökohde oli vaihtoehtona piikivelle kipinöiden sytyttämisessä – tästä nimi pyriitti – ja sitä käytettiinkin usein tällä tavoin varhaisissa pistoolissa. Sitä on pitkään käytetty myös rautasulfaatin valmistukseen, joka tunnetaan perinteisesti vihreänä vitriolina. Rautadisulfidia käytetään edelleen joskus tällä tavoin, vaikkakin kehittyneemmillä mekanismeilla kuin perinteisellä menetelmällä, jossa pyriittikasa jätettiin sateeseen ja kerättiin siitä tippuva neste.
Mineraalin hapettuessa siitä vapautuu melkoinen määrä lämpöä, mikä voi johtaa räjähdyksiin hiilikaivoksissa, joissa on korkea rikkipitoisuus. Tämä taipumus hapettumiseen ei kuitenkaan tarkoita, että rauta II-disulfidi olisi aina lukittuna. Kiillotettua pyriittiä on käytetty koruissa antiikin ajoista lähtien, ja sen melko tummat kiteet (niissä on harvoin kullan kiiltoa) olivat erityisen muodikkaita 1700-luvun lopun ja 1900-luvun alun välillä.

Lähde: ©
Markasiittirintakoru
Hämmentävää kyllä, pyriitistä valmistettuja koruja sanotaan markasiittikoruiksi – hämmentävää siksi, että on olemassa myös vaihtoehtoinen rauta-II-disulfidimineraali nimeltä markasiitti, jossa kuutiorakennetta venytetään niin sanottuun orthorhombiseen muotoon. Tämä muoto soveltuu huonommin jalokivien valmistukseen, koska se on hauraampi ja todennäköisesti murenee. Jalokiven nimi (Yhdistyneessä kuningaskunnassa usein lausutaan ”marca-seet”) juontaa juurensa aikaan, jolloin mineraalin kaikki muodot tunnettiin nimellä markaasiitti.

Lähde: ©
Markaasiittimineraali
Rauta II-disulfidi ei kuitenkaan ole suinkaan ainoa tapa, jolla rauta ja rikki voidaan yhdistää. Paljon vähemmän houkuttelevan näköinen rauta II sulfidi on musta pilkullinen aine, jonka rakenne on oktaedrinen raudan ympärillä. Yhdistettä muodostuu varsin usein orgaanisen aineksen hajotessa, olipa kyse sitten suon mustasta lietteestä tai ylikypsennetyn munankeltuaisen tummasta värimuutoksesta.
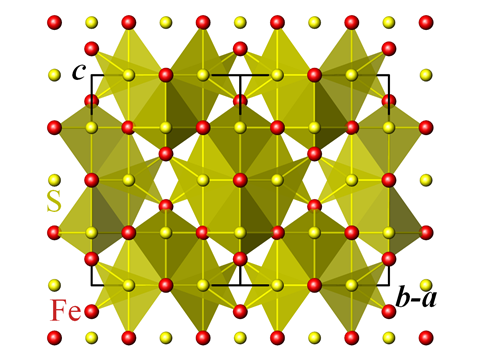
Lähde: Perditax
Greigiitin kiderakenne
Tämä on vasta alkua rautasulfidin hienovaraisille muunnoksille. Greigiitiksi, mackinawiitiksi ja pyrrhotiitiksi kutsutuilla mineraaleilla on rakenteen muunnelmia, kun taas rauta-III-sulfidin mustaa jauhetta – Fe2S3 – on koskaan tuotettu vain keinotekoisesti. Greigiitti on osa vasta vuonna 1975 löydetyn meribakteeriryhmän kykyjä, joilla on huomattava kyky suuntautua maan magneettikentän mukaan. Näitä ”magnetotaktisiksi” kutsuttuja bakteereja kutsutaan, ja niiden soluissa olevat kiteet ovat enimmäkseen greigiittiä, joka on tunnetuimman luonnossa esiintyvän magneettisen aineen, rautaoksidimagnetiitin, rautasulfidiekvivalentti.

Lähde: Raymond T. Downward, NASA
Mundrabilla-meteoriitin kaiverrettu pinta, jossa näkyy oikealla alhaalla, vasemmalla alhaalla ja vasemmalla ylhäällä metallinen rauta-nikkeliseosfaasi, joka koostuu kamsiitista (38 % Ni) ja taeniitista (6 % Ni). Tummempi materiaali on rautasulfidia (FeS tai troiliitti), jonka rinnalla on duabreeliitin (rautakromisulfidi (FeCr2S4)) samansuuntaisia saostumia.
Vaihtoehtoisista rakenteista ehkä mielenkiintoisin on troiliitti, toinen rautasulfidin muoto, jolla on kuusikulmainen rakenne. Vaikka tätä esiintyy satunnaisesti Maassa syntyperäisenä, sitä esiintyy useimmiten meteoriiteissa – erityisesti suhteellisen harvinaisissa lajikkeissa, jotka ovat peräisin Kuusta ja Marsista ennen kuin ne on räjäytetty pois maan pinnalta avaruuden törmäyksessä.

Nimi troiliitti annettiin italialaisen papin Domenico Troilin kunniaksi, joka teki ensimmäisen kirjatun havainnon meteorista, joka johti kappaleen iskeytymiseen maahan vuonna 1766. Troili luuli meteoriitin päämateriaaliksi markasiittia (tarkoittanee pyriittiä), mutta lähes sata vuotta myöhemmin saksalainen mineralogi Gustav Rose tunnisti meteoriitin koostumuksen erilaiseksi rautasulfidiksi ja nimesi sen Troilin mukaan.
Rautasulfidi voi olla riesa. Se voi kerääntyä esimerkiksi öljy- ja kaasukaivoihin, jolloin putket turpoavat. Muualla se on kuitenkin osoittautunut hyväksi. Se voi olla kahden yksinkertaisen kemiallisen alkuaineen yksinkertainen yhdiste ja pyriitin tavoin petollinen valekulta, mutta moninaisissa muodoissaan se osoittaa monimuotoisuutta ja sopeutumiskykyä, joka tekee sen käyttäjistä kaikkea muuta kuin hölmöjä.
Ben Valsler
Tässä Brian Clegg puolusti rautasulfidia. Ensi viikolla Mike Freemantle kerosiinin ja epätavanomaisen sodankäyntimuodon parissa.
Michael Freemantle
Noin kuukausi japanilaisten Pearl Harboriin joulukuussa 1941 tekemän hyökkäyksen jälkeen amerikkalainen hammaslääkäri keksi suunnitelman, jonka mukaan japanilaisia kaupunkeja voitaisiin tuhota kiinnittämällä lepakoiden ympärille pikkuruisia polttopommeja.
Ben Valsler
Seuratkaa seuraavalla kerralla, mitä tapahtui projektin röntgenkuvauksessa. Siihen asti voit lähettää sähköpostia osoitteeseen [email protected] tai twiitata @chemistryworld, jos sinulla on toiveita yhdisteistä, jotka meidän pitäisi sisällyttää podcastiin. Olen Ben Valsler, kiitos kun liityit seuraani.
Vastaa