Reaktiossa ammoniakin kanssa, miksi vesi on happo?
Tämä on loistava yleisen kemian reaktio, jolla on tärkeitä orgaanisen kemian vaikutuksia. Toinen samanlainen kysymys on, miksi vesi on emäs, kun se reagoi ”hapon” kanssa? Vastaus molempiin kysymyksiin on: kaikki on suhteellista! Täällä StudyOrgossa saamme usein tämänkaltaisia kysymyksiä orgaanisen kemian aiheista, jotka on yleensä käsitelty nopeasti, kuvattu huonosti tai joiden oletetaan olevan tuttuja aiemmilta kursseilta. Nämä käsitteet ovat todella tärkeitä tulevien monimutkaisempien aiheiden ymmärtämiseksi. StudyOrgon jäsenyydellä saat vielä enemmän vinkkejä ja niksejä orgaanisen kemian aiheista sekä yksityiskohtaisia mekanismeja selityksineen. Tämänpäiväinen blogi on esimakua saatavilla olevista yksityiskohtaisista aiheista ja materiaaleista. Tutustu StudyOrgo.comin jäsenyyteen ja rekisteröidy jo tänään!
Muista, että happojen ja emästen osalta on olemassa kaksi määritelmää; Bronstedin ja Lewisin määritelmä. Bronstedin hapot määritellään protonien luovuttajiksi, kun taas Lewisin hapot määritellään elektronien vastaanottajiksi. Molemmat ovat happoja, mutta ajattelemme eri tavalla sitä, onko kyseessä protonit vai elektronit. Vesiliuoksessa, yleiskemiassa tai biokemiassa ajattelemme pääasiassa Bronstedin määritelmää, koska happojen protonien dissosiaatio muuttaa liuoksen H+ -pitoisuutta, minkä tulkitsemme pH:n muutokseksi ja liuoksen ”happamuudeksi”. Mittaamme happojen protonien dissosioitumista eli protonien hyväksymistä emäksille numeerisella arvolla, joka on pKa. Mitä suurempi pKa on, sitä heikompi happo ja vahvempi emäs. Mitä pienempi pKa, sitä vahvempi happo ja heikompi emäs. Helppo temppu pKa:n ajattelemiseksi on sijoittaa molekyylin protonoitu versio vasemmalle ja ajatella sitä protonien luovuttajana. PKa kertoo kuinka helppoa tämä luovutus on, mitä pienempi luku sitä helpompi protoninluovutus on.
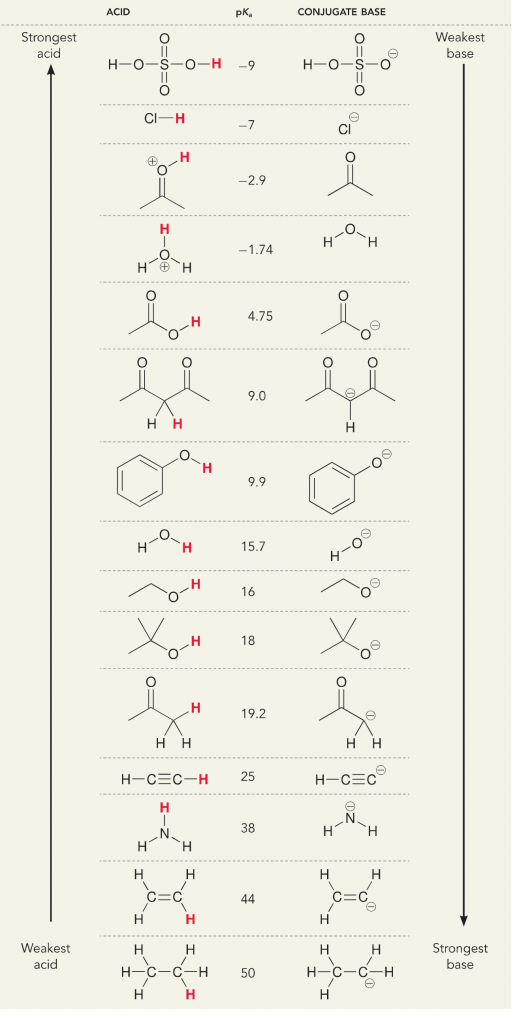
Katsotaanpa ammoniakin ja veden reaktiota; veden pKa:ksi on määritelty 14. Ammoniakin pKa on ~37.
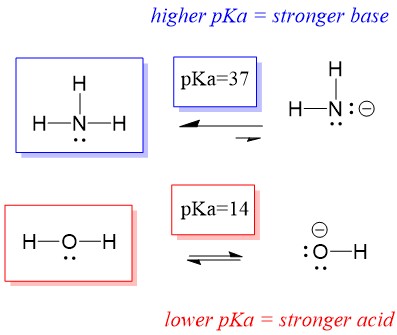
Koska siis veden pKa on alhaisempi kuin ammoniakin, se on vahvempi happo kuin ammoniakki ja luovuttaa ammoniakin emäkselle protoneita. Tämä reaktio johtaa siihen, että vedestä tulee konjugoitu emäs OH- ja ammoniakista konjugoitu happo NH4+. Mielenkiintoista on, että juuri tämän vuoksi ammoniakki on syövyttävä aine, se tuottaa hydroksidia, joka reagoi tahrojen ja mikro-organismien kanssa puhdistaakseen ja desinfioidakseen tehokkaasti kotitaloustavaroita.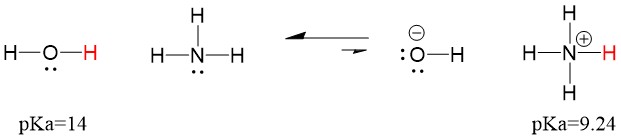
Tämä on tärkeää orgaanisen kemian käsitteenä, koska happojen ja emästen vahvuus elektronien suhteen eli Lewisin määritelmä on juuri se, miten ajattelemme sidosten rikkoutumisen ja muodostumisen mekanismeja; elektronien virtaus. Lewisin happojen ja konjugoidun hapon vahvuus voi auttaa tunnistamaan, mihin suuntaan reaktio etenee. Voimme nähdä, että veden ja ammoniakin reaktio on epäedullinen, mutta todellisuudessa tapahtuu riittävästi reaktiota, jotta veden pH laskee merkittävästi (pH~11 ammoniakin kanssa).
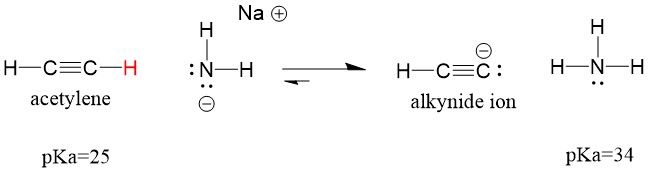
Katsotaanpa asetyleeniä, joka reagoi emäksen kanssa muodostaen alkynidi-ionin, joka on käyttökelpoinen nukleofiili C-C-sidoksen muodostuksessa. Jos yritämme reagoida natriumhydroksidin kanssa alkynin kanssa, alkynidi-ionia EI muodostu. Tämä johtuu siitä, että reaktion konjugoitunut happotuote vesi, jonka pKa on 15, on VAHVEMPI kuin alkuperäinen happo asetyleeni (pKa = 25). Reaktiot suosivat AINA heikomman hapon eli tässä tapauksessa reaktiopuolen muodostumista.
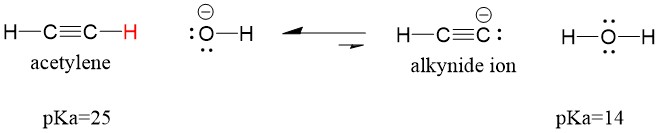
Jos vaihdamme emäksemme natriumamidiin, joka on paljon vahvempi emäs, alkynidi-ionia TULISI muodostua. Tämä johtuu siitä, että reaktion konjugoitunut happotuote on ammoniakki, jonka pKa on 38 ja joka on heikompi konjugoitunut happo kuin alkuperäinen happo asetyleeni (pKa = 25). Tällöin reaktio suosii tuotepuolta!

Vastaa