- Mitä on rauta
- Missä rautaa esiintyy
- Historia
- Tunniste
- Luokitus, Raudan ominaisuudet ja ominaisuudet
- Yleiset ominaisuudet
- Fysikaaliset ominaisuudet
- Kemialliset ominaisuudet
- Raudan atomitiedot (alkuaine 26)
- Mitkä ovat raudan yleiset käyttötarkoitukset
- Onko alkuaineella myrkyllisiä vaikutuksia
- Interenkiintoisia faktoja
- Rautametallin hinta
Mitä on rauta
Rauta (lausutaan EYE-ren) on kova metalli, jolla on suuri kaupallinen arvo ja joka kuuluu siirtymämetallien perheeseen. Sitä edustaa kemiallinen symboli Fe, se on kemiallisesti reaktiivinen ja sillä on taipumus ruostua helposti ilmassa muodostaen punertava kerros nimeltä ruoste, kun se altistuu kostealle ilmalle .

Raudan symboli
Missä rautaa esiintyy
Rauta on maankuoren neljänneksi runsain metalli, ja se liittyy yleisesti muihin mineraalimalmeihin, kuten hematiittiin, takoniittiin ja magnetiittiin, joita löytyy Ukrainan, Brasilian, Venäjän, Australian ja Kiinan kaivosvarannoista. Sen kaupallinen tuotanto tapahtuu masuunissa kuumentamalla malmit koksin ja kalkkikiven kanssa.
Historia
Nimen alkuperä:
Kuka sen löysi: Tuntematon
Milloin, missä ja miten se löydettiin
Noin 3500 eKr. egyptiläisten uskotaan käyttäneen rautaesineitä. Vähä-Aasiasta kotoisin olevien heettiläisten tiedetään sulattaneen metallia sen malmeista 1500 eaa. aikana. Vuonna 1722 ranskalainen entomologi René Antoine Ferchault de Réaumur julkaisi kirjan, jossa hän kuvasi eri rautaseosten merkitystä .

Rautametalli
Tunniste |
|||
| Atominumero | 26 | ||
| CAS-numero | 7439-89-6 | ||
| Sijainti jaksollisessa järjestelmässä | Ryhmä | Jakso | Lohko |
| 8 | 4 | d | |
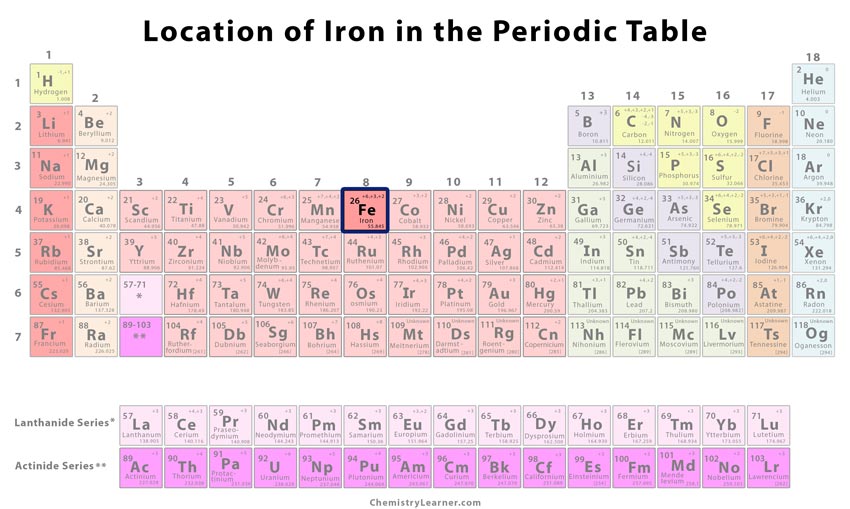
Missä kohtaa jaksollista järjestelmää rauta on
Luokitus, Raudan ominaisuudet ja ominaisuudet
Yleiset ominaisuudet |
||
| Relatiivinen atomimassa | 55.845 | |
| Atomimassa/paino | 55.845 atomimassayksikköä | |
| Molaarinen massa/molekyylipaino | 55.845 g/mooli | |
| Massaluku | 56 | |
Fysikaaliset ominaisuudet |
||
| Väri/fysikaalinen ulkomuoto | Hopeanharmaa | |
| Sulamispiste/jäätymispiste | 1538°C (2800°F) | |
| Kiehumispiste | 2861°C (5182°F) | |
| Tiheys | 7.87 g/cm3 | |
| Vakiolämpötila/luonnontila huoneenlämmössä (kiinteä/neste/kaasu) | Kiinteä | |
| Mallinnettavuus | Kyllä | |
| Halkeavuus | Kyllä | |
| Kovuus | 4-5 Mohs | |
| Ominaislämpökapasiteetti | 0.444 J g-1 oC | |
| Lämmönjohtavuus | 80.4 Wm-1K-1 | |
Kemialliset ominaisuudet |
||
| Syttyvyys | Ei ole syttyvää | |
| Hapettumisasteet (numerot) | 6, 3, 2, 0,-2 | |
Raudan atomitiedot (alkuaine 26)
| Elektronikonfiguraatio (jalokaasukonfiguraatio) | 3d64s2 | ||||||
| Atomirakenne | > | ||||||
| – Elektronien lukumäärä | 26 | ||||||
| – Neutronien lukumäärä | 30 | ||||||
| – lukumäärä. Protonien | 26 | ||||||
| Atomin säde | |||||||
| – Atomin säde | 2.04 Å | ||||||
| – Kovalenttinen säde | 1.24 Å | ||||||
| Ionisaatioenergia
(kJmol-1) |
1. | 2. | 3. | 4. | 5. | 6. | 7. |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
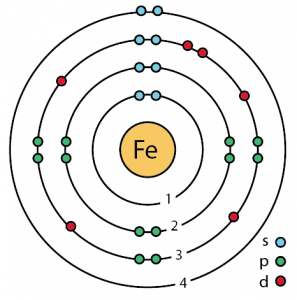
Raudan atomirakenne (Bohrin malli)
Mitkä ovat raudan yleiset käyttötarkoitukset
- Rautaa käytetään erilaisten terästyyppien valmistuksessa seostamalla sitä muiden alkuaineiden, kuten hiilen kanssa, nikkeliä, kromia ja volframia leikkuulaitteiden, polkupyöräketjujen, kiväärinpiippujen, voimansiirtotornien, siltatukien ja teräsbetonin valmistukseen.
- Ruostumattomalla teräksellä, joka sisältää suuren prosenttiosuuden rautaa yhdessä muiden metallien kanssa, on valtava lujuus ja parempi toiminta, joka on hyödyllinen kirurgisten instrumenttien, paperiliittimien, ruokailuvälineiden, kuulalaakereiden ja korujen valmistuksessa .
- Toisesta Fe:n muodosta, jota kutsutaan takoraudaksi ja jota saadaan sulattamalla, valmistetaan puusepäntyökaluja, nostokoukkuja, ketjuja, aitoja ja portteja .
- Rautatäytteitä käytetään sähkömagnetismin tieteellisissä kokeissa magneettien voimakkuuden arvioimiseksi sekä voimametallurgiassa, taideteoksissa, ilotulitteissa ja hiekkapuhalluksessa .
- Fe toimii tehokkaana katalysaattorina joissakin teollisissa kemiallisissa prosesseissa, kuten Haber-prosessissa ja Fischer-Tropschissa .

Rautapalkki
Onko alkuaineella myrkyllisiä vaikutuksia
Fe:n satunnaiseen nauttimiseen on yhdistetty oksentelua, ripulia ja muita ruoansulatuskanavan ongelmia, jotka ovat yleisiä metallimyrkytyksiä. Pitkäaikainen kertyminen elimistöön voi johtaa hengitysvaikeuksiin ja sydänsairauksiin . Metallipölyn tai -höyryjen hengittäminen voi aiheuttaa vakavan keuhkoreaktion .
Interenkiintoisia faktoja
- Meteoriittien uskotaan sisältävän runsaasti rautaa .
- Vanhan ajan merenkulkijat käyttivät rautaa magneettisena metallina lodekivien muodossa kompassin valmistukseen .
- Esimiesten keskivertoihmisessä elimistössä on Fe:tä keskimäärin 4 grammaa ja se on yhdistetty hemoglobiiniin, joka vuorostaan auttaa kuljettamaan happea keuhkoihin .
-

Rautajauhe
Rautametallin hinta
Puhtaan raudan hinta voi vaihdella 0,24 ja 0,30 dollarin välillä kilolta.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Vastaa