Proteopediasta
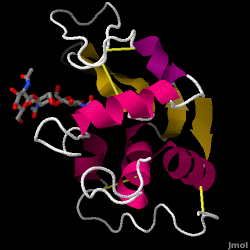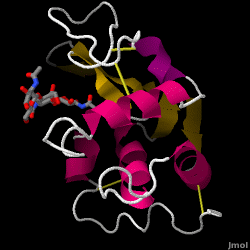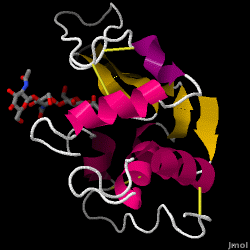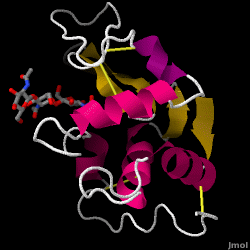
Lysotsyymi – joka tunnetaan myös nimellä muramidaasi – on voimakas entsyymi, jota esiintyy runsaasti kyynelissä, syljessä ja ihmisen maidossa. Ihmisillä sitä koodaa LYZ-geeni. Koska se on pieni, helposti saatavilla oleva ja erittäin stabiili proteiini, sen toimintaa ja rakennetta on tutkittu laajasti.
Johdanto
Lysotsyymi toimii epäspesifisenä puolustuksena bakteereja ja sieniä vastaan. Se on osa synnynnäistä immuunijärjestelmää, ja se on tärkeä osa imeväisen ruokavaliota ripulin torjumiseksi. Se on entsyymi, joka tunnetaan kyvystään hajottaa monenlaisten soluseinien polysakkaridiarkkitehtuuria tavallisesti suojautuakseen bakteeritartunnalta. Tämän artikkelin aiheena olevan kananmunan valkuaisen (HEW) lysotsyymin rakenne on esitetty oikealla. Laschtschenko kuvasi kananmunan valkuaisen antibakteerisen aktiivisuuden ensimmäisen kerran vuonna 1909. Alexander Fleming, jota pidetään myös penisilliinin keksijänä, luonnehti sen ja antoi sille nimen ”lysotsyymi”. Entsymaattisen aktiivisuuden löytäminen tapahtui vahingossa; asiaan liittymättömän kokeen aikana nenän tippa joutui epähuomiossa bakteeriviljelmää sisältävään petrimaljaan, jossa näkyi vielä tuntemattoman entsymaattisen reaktion tuloksia. Tämän tuntemattoman reaktion havaitseminen johti reaktion komponenttien jatkotutkimuksiin sekä uuden löydetyn ”lysotsyymin” vastaavaan tunnistamiseen. Vuonna 1965 David C. Phillips työtovereineen määritti lysotsyymin kolmiulotteisen rakenteen 2 Å:n resoluutiolla . Phillipsin työ oli erityisen uraauurtava, koska Phillips oli onnistunut selvittämään entsyymin rakenteen röntgenkristallografian avulla, mihin ei ollut ennen pystytty. Phillipsin tutkimus johti myös rakenteeseen perustuvaan hypoteesiin entsyymin toimintamekanismista.
Toiminta
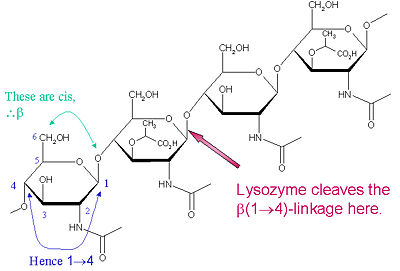
Tämän pilkkomistyypin erityinen mieltymyssubstraatti on (NAG-NAM)₃-heksasakkaridi, jonka sisällä substraatin sisällä esiintyy pilkkomiskohteena oleva glukosidinen tavoitesidos, NAM₄-β-O-NAG₅. Yksittäiset heksasakkaridisidosyksiköt on nimetty A-F, ja NAM₄-β-O-NAG₅-glykosidisidoksen halkaisupreferenssi vastaa D-E-yksikön glykosidisidoksen cl
Lysotsyymi on tunnettu siitä, että se vaurioittaa bakteerien soluseinämiä katalysoimalla 1:n hydrolyysiä,peptidoglykaanin N-asetyyli-muramiinihappo- (NAM) ja N-asetyyli-D-glukosamiinijäämien (NAG) sekä kitodekstriinien N-asetyyli-D-glukosamiinijäämien välisiä 4-beta-sidoksia. Tällä tavoin lysotsyymi kykenee tehokkaasti lysoimaan sekä bakteerien että sienten soluseinät. Lysotsyymin pilkkomiskohta tässä arkkitehtuurissa on β(1-4)-glykosidisidos, joka yhdistää NAM:n C1-hiilen NAG:n C4-hiileen.
Tämän halkaisutyypin erityinen substraatti on (NAG-NAM)₃-heksasakkaridi, jonka sisällä substraatin sisällä esiintyy pilkkoutuva kohdeglykosidisidos, NAM₄-β-O-NAG₅. Yksittäiset heksasakkaridisidosyksiköt on merkitty A-F, ja NAM₄-β-O-NAG₅-glykosidisidoksen halkaisupreferenssi vastaa D-E-yksikön glykosidisidoksen halkaisupreferenssiä. Riippuen siitä, mistä organismista lysotsyymi on saatu, glykosidisidoksen hydrolyysi tapahtuu säilyttämällä konfiguraatio anomeerisen hiilen kohdalla (kananmunan valkuainen) tai inversiolla (hanhi, faagi T4).
Lysotsyymi vaikuttaa tehokkaasti pitkiin (NAG-NAM) tai (NAG) polymeereihin. Kun ketjun pituus pienenee alle kuuteen monomeeriin, katalyyttiset nopeudet laskevat huomattavasti; itse asiassa trisakkaridit toimivat kilpailevina inhibiittoreina sitoutumalla aktiiviseen kohtaan tuottamattomassa rekisterissä.
Henin kananmunan valkuaista lysotsyymiä (PDB-koodi 1hew)
Mekanismi
Kanananmunanvalkuaisen lysotsyymin glykosidisidosten hydrolyysi etenee konfiguraation säilyttäen. Vuonna 1953 Koshland ehdotti, että yleensä konfiguraation säilyttäminen merkitsee kaksoissiirtymismekanismia (kun taas konfiguraation kääntyminen merkitsee yksinkertaista siirtymistä). Vuosikymmenien ajan tarkasteltiin kahta kilpailevaa mekanistista hypoteesia (Phillips: dissosiatiivinen mekanismi, jossa välituotteena on oksokarbeenium; Koshland: kaksivaiheinen assosiatiivinen mekanismi, jossa välituotteena on kovalenttinen entsyymikompleksi), ja vuonna 2001 saadut tiedot kallistavat vaakakuppia kohti kovalenttisen välituotteen olemassaoloa. Substraattikompleksin rakenteen puuttuminen vaikeutti varmasti mahdollisten mekanismien erottamista toisistaan, samoin kuin kahden erilaisen mekanismin (retentio ja konfiguraation inversio) olemassaolo saman rakenteellisen entsyymiperheen sisällä (esim. kanan vs. hanhen entsyymi).
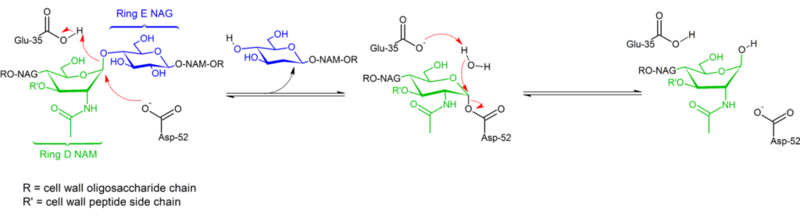
Lysotsyymi hydrolysoi glykosidia (tästä johtuu lysotsyymin familiaalinen luokittelu glykosylaasiksi), mikä vastaa asetaalin muuntumista hemiasetaaliksi. Reaktio etenee kahdessa vaiheessa, kuten yllä olevassa kuvassa on esitetty. Ensimmäisessä vaiheessa Asp 52 toimii nukleofiilinä ja osa sokerista on poistuva ryhmä. Toisessa vaiheessa vesi toimii nukleofiilinä ja Asp 52 toimii poistuvana ryhmänä. Molemmissa vaiheissa konfiguraatio kääntyy anomeerisen hiilen kohdalla, jolloin konfiguraatio säilyy kokonaisuudessaan. Glu 35 toimii happona ensimmäisessä vaiheessa (protonoimalla sokerin glykosidisen sidoksen, jolloin siitä tulee parempi elektrofiili) ja emäksenä toisessa vaiheessa (deprotonoimalla veden, jolloin siitä tulee parempi nukleofiili). Vaikka kuvassa on esitetty joitakin sokereita venekonformaatiossa korostamaan konfiguraation inversiota, näitä ei havaita kokeellisesti, vaan ne ovat pikemminkin tuolikonformaatiossa.
Lysotsyymin sovellukset
Koska lysotsyymi on laajalti tunnettu antibakteerisista ja sienilääkkeellisistä ominaisuuksistaan, sillä on monenlaisia käyttötarkoituksia sekä biokemiallisissa että farmaseuttisissa sovelluksissa. Molekyylibiologiassa lysotsyymiä käytetään usein emäksisessä liuotusmenetelmässä plasmidi-DNA:n uuttamiseksi ja eristämiseksi. Sitä käytetään laajalti lääkealalla grampositiivisten bakteerien tuhoamiseen, ja sitä voidaan käyttää tukemaan jo olemassa olevaa immuunipuolustusta bakteeri-infektioiden torjumiseksi. Tämä entsyymi on erityisen tärkeä imeväisten bakteeritautien ehkäisyssä. Antibakteeristen ominaisuuksiensa vuoksi lysotsyymiä voidaan käyttää myös elintarviketeollisuudessa estämään elintarvikkeiden pilaantumista.
Katso myös
- Lysotsyymin 3D-rakenteet
- Lysotsyymi
- Säilyttävät glykosidihydrolaasit
- Molekyylinen leikkikenttä/Lysotsyymi
- Käyttäjä:Judy Voet/Lysotsyymi
- Lysotsyymi (arabia)
- Lysotsyymi (heprea)
- Ragland SA, Criss AK. Bakteerien tappamisesta immuunimodulaatioon: Uusimmat oivallukset lysotsyymin tehtävistä. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming,A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Kananmunan valkuaisen lysotsyymin rakenne. Kolmiulotteinen Fourier-synteesi 2 Angstromin resoluutiolla. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. An Introduction to Enzyme and Coenzyme Chemistry. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Kananmunan valkuaisen lysotsyymin aktiivisuuden kristallografiset tutkimukset. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Image from: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Proteiinien varhaiset nauhapiirrokset. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Kananmunan valkuaisen lysotsyymin rakenne. Kolmiulotteinen Fourier-synteesi 2 Angstromin resoluutiolla. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Joidenkin kiteisten lysotsyymi-inhibiittorikompleksien rakenne määritettynä röntgenanalyysillä 6 Angstromin resoluutiolla. Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. Kananmunan valkuaisen lysotsyymin katalyysi etenee kovalenttisen välituotteen kautta. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers ja Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysotsyymi
Proteopedia Sivun avustajat ja toimittajat (mikä tämä on?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
Vastaa