Keywords
CADASIL – aivohalvaus – magneettikuvaus
Introduction
Cerebral Autosomaalinen dominoiva arterioottinen aivoverenkiertohäiriö, johon liittyy aivokuoren alapuolisia infarkteja ja leukoenkefalopatiaa (CADASIL), on perinnöllinen pienten verisuonten tauti, jonka aiheuttajina ovat erilaiset patogeneettisesti vaikuttavat mutaatiot NOTCH-3-geenissä. Sille on ominaista migreeni auran kanssa, psykiatriset oireet, toistuvat sepelvaltimotapahtumat varhaisessa iässä ja kognitiivinen heikkeneminen. Tämä ja sille tyypilliset radiologiset löydökset auttavat meitä yleensä epäilemään tautia. Sitä pidetään yleensä nuorten ja keski-ikäisten aikuisten sairautena, mutta iäkkäiden tapaukset saattavat olla alidiagnosoituja. Raportoimme tapauksesta, jossa mies sai CADASIL-diagnoosin seitsemänkymppisenä tyttärensä aikaisemman diagnoosin ansiosta.
Tapausselostukset
Tapaus 1
Potilaamme tytär oli 50-vuotias, kun hänet lähetettiin neurologian poliklinikalta sairaalaamme jatkotutkimuksiin, koska hänen aivojensa magneettikuvauksen radiologiset löydökset koostuivat valkean aineen muutoksista molemmissa ulkokapselitumakkeissa, molemminpuolisilla periventrikulaarisilla alueilla ja vasemmassa ohimolohkossa.
Hän kävi edellä mainitulla klinikalla, koska hän oli kärsinyt 30 vuoden ajan migreenistä visuaalisen auran kanssa, ja joissakin jaksoissa hänellä oli visuaaliseen auraan viittaavia jaksoja ilman päänsärkyä. Muita oireita hänellä ei ollut. Hän oli allerginen fosfomysiinille ja hänelle oli lapsena tehty nielurisaleikkaus. Hänellä ei ollut muuta aiempaa sairaushistoriaa. Hänen perhehistoriansa oli merkittävä: hänen äidillään oli migreeni ja lievä dementia, ja hänen isänsä oli saanut aivohalvauksen 75-vuotiaana; hänen isänpuoleisella isoisällään, sedällään ja tädillään oli ollut aivohalvauksia, ja sedällä oli diagnosoitu Alzheimerin tauti, isänpuoleinen serkku oli saanut muualla diagnoosin ”ANA+ vaskuliitti”, ja toisella isänpuoleisella serkulla oli diagnosoitu multippeliskleroosi. Hänellä oli kaksi tervettä poikaa. Fyysinen tutkimus, mukaan lukien huolellinen neurologinen tutkimus, oli täysin normaali. Toistuva aivojen magneettikuvaus osoitti useita hyperintensiivisiä leesioita posteriorisen protuberanssin valkeassa aineessa, periventrikulaarisilla ja subkortikaalisilla alueilla, mukaan lukien anterioriset ohimolohkot, erityisesti vasen, molemmat centrum semiovale -alueet, sisäinen ja ulkoinen kapseli, eikä merkkejä viimeaikaisista tai aiemmista mikroverenvuodoista (kuva 1). Kaikki muut tutkimukset, mukaan lukien hemogrammi, glukemia, maksan ja munuaisten toiminta, erytrosyyttien laskeutumisnopeus, seerumin kilpirauhashormonit, hyperkoagulabiliteettitutkimus, vaskuliittitutkimus, EKG, rintakehän röntgenkuvaus, syfilis- ja HIV-serologiat sekä supraaortan runkojen ultraäänitutkimus Doppler-kuvauksella, olivat normaaleja lukuun ottamatta kolesterolemiaa, joka oli 220 milligrammaa/dl, ja kolesterolipitoisuus, jonka yhteydessä LDL-kolesterolipitoisuus oli 152 mg/dl. Myös ihobiopsia oli normaali. NOTCH 3 -geenin neljännestä eksonista löytyi Arg169Cys-mutaatio (sytosiinin vaihtuminen tymiiniksi 505-kodonissa), jonka tiedetään olevan patogeneettinen, joten hänellä todettiin CADASIL. Tämän diagnoosin myötä molemmat vanhemmat arvioitiin klinikallamme.
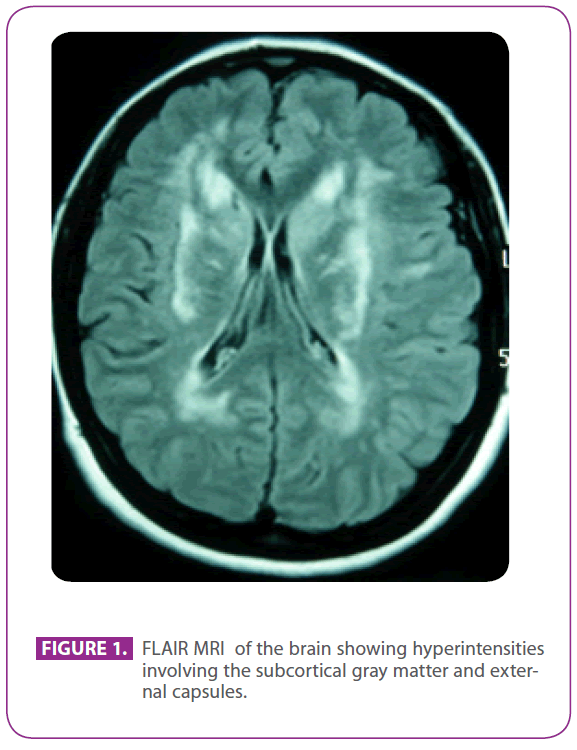
Kuva 1: Aivojen FLAIR-MRI-kuvaus, jossa näkyy hyperintensiteettejä, jotka koskevat subkortikaalista harmaata ainetta ja ulkoisia kapseleita.
Tapaus 2
Äiti oli 78-vuotias. Hänellä oli ollut pitkään migreeni ilman auraa, ja kahden viime vuoden aikana hänelle oli kehittynyt lievä dementia, johon liittyi symmetristä parkinsonismia, vaihteluita ja REM-unikäyttäytymishäiriöitä, mikä viittasi Lewyn kappaleisiin liittyvään dementiaan. Aivojen magneettikuvaus sulki pois merkityksellisen valkean aineen sairauden.
Hänen isänsä oli 79-vuotias mies, jolla oli useita verisuonitautien riskitekijöitä: tyypin 2 diabetes mellitus, dyslipidemia ja tupakointi 50 vuoden ajan, kertyneen indeksin ollessa 15 pakkausvuotta, vaikka hän oli lopettanut kolme vuotta sitten. Hänellä oli iskeeminen sydänsairaus ja posteroinferiorinen sydäninfarkti vuonna 1991. Viimeisten 8 vuoden aikana hänellä oli ollut kolme ohimenevää sepelvaltimotautia ja yksi lakunaarinen aivohalvaus, jotka liittyivät eri valtimoiden alueisiin, ja hänellä oli asteittain heikentynyt kävelykyky, ja viimeisten kuuden kuukauden aikana hänestä oli tullut hieman vetäytyvä ja apaattinen. Hänellä ei ollut aiemmin ollut migreeniä. Hän käytti metformiinia, klopidogreelia, atenololia ja atorvastatiinia. Fyysisessä tutkimuksessa hän oli tajuissaan ja orientoitunut, mutta hieman tarkkaamaton, kieli sekä kauko- ja äskettäinen muisti olivat normaalit, hänellä oli ideomotorinen apraxia, muuttunut samankaltaisuuksien ja sanontojen tulkinta, eikä hänellä ollut frontaalisia vapautumisrefleksejä. Hänellä ilmeni myös globaalia hyperrefleksiaa, johon liittyi molemminpuoliset flexor plantar -refleksit, ja kävelyssä oli lyhyitä askelia ja käsien liikkeet olivat heikentyneet. Kaksi vuotta aiemmin, yhden ohimenevän iskeemisen kohtauksen jälkeen suoritettu tietokonetomografiakuvaus osoitti laajaa valkean aineen sairautta, joka korostui erityisesti ulkokapselissa ja ohimolohkoissa (kuva 2).
Yhteenvetona voidaan todeta, että potilaalla oli toistuvia iskeemisiä aivohalvauksia, lievää subkortikaalista kognitiivista heikkenemistä ja leukoenkefalopatiaa, mikä oli erittäin epäilyttävää, kun otetaan huomioon tyttärensä diagnoosi. Tehtiin geenitesti, joka osoitti saman NOTCH 3 -mutaation kuin hänen tyttärellään ja vahvisti diagnoosin. Se voi kuitenkin olla myös sporadinen, sillä de novo -mutaatioita on kuvattu. Sen aiheuttavat erilaiset patogeeniset mutaatiot NOTCH-3-geenissä, joka sijaitsee kromosomissa 19, lokuksessa 19p13.2-p13.1, ja koostuu 33 eksonista, jotka koodaavat 2321 aminohappoa sisältävää proteiinia (1). Tämä proteiini on yhden läpiviennin transmembraaninen solupintareseptori, joka ilmentyy systeemisissä valtimoiden sileissä lihassoluissa ja jolla on solunulkoinen säätelydomeeni ja solunsisäinen transduktoridomeeni. Tähän mennessä on raportoitu yli 190 mutaatiota, jotka voivat johtaa CADASILiin, ja ne kaikki esiintyvät NOTCH 3 -geenin eksoneissa 2-24, jotka koodaavat NOTCH 3 -geenin solunulkoisen osan 34 epidermisen kasvutekijän kaltaista toistoa. Siksi näiden 23 eksonin seulonnalla on 100-prosenttinen herkkyys ja lähes sama spesifisyys (2). Näistä mutaatioista yli 180 on missense-mutaatioita, vähintään 6 deleetioita, yksi insertio, yksi frameshift ja 2 duplikaatiota. Suurin osa patogeneettisistä NOTCH3-mutaatioista esiintyy eksoneissa 3 ja 4 (3).
Kaikki mutaatiot johtavat kysteiinijäännöksen lisäämiseen tai menettämiseen EGF:n kaltaisessa toistossa ja siten kysteiinijäännöksien parittomaan lukumäärään, mikä aiheuttaa epänormaalien disulfidisiltojen muodostumista. NOTCH3-mutaatio aiheuttaa verisuonten sileiden solujen rappeutumista pienissä valtimoissa ja arterioleissa ja epänormaalin proteiinin kertymistä näiden verisuonten seinämään, mikä johtaa luumenin ahtautumiseen (1). Aivoissa se vaikuttaa läpäiseviin aivo- ja leptomeningeaalisiin valtimoihin aiheuttaen näiden verisuonten kyvyttömyyttä autoregulaatioon ja niiden kastelemien alueiden hypoperfuusiota ja siten infarkteja valkeassa aineessa.
Ensimmäinen oire CADASILin ilmaantuessa on tavallisesti migreeni, johon liittyy aura ja jonka keskimääräinen alkamisikä on 30 vuotta. Sitä esiintyy 20-40 prosentilla potilaista (4). Useimmat kohtaukset ovat tyypillisiä ja niihin liittyy visuaalinen tai sensorinen aura, mutta puolella potilaista on myös epätyypillisiä kohtauksia, joihin liittyy basilaarinen, hemipleginen tai pitkittynyt aura.
Subkortikaalisia iskeemisiä tapahtumia, ohimeneviä kohtauksia tai aivohalvauksia, ilmaantuu 60-85 %:lla potilaista, ja niitä ilmaantuu ensimmäisen kerran keskimäärin 50 vuoden iässä, vaikka ne voivat ilmaantua jo toisella vuosikymmenellä. Useimmiten perinteisiä vaskulaarisia riskitekijöitä ei ole tai ne eivät ole kovin merkittäviä. Kahdella kolmasosalla potilaista iskeeminen tapahtuma ilmenee kliinisesti ja radiologisesti lakunaarisena oireyhtymänä. Suurimmalla osalla potilaista on useita aivohalvauksia, yleensä 2-5, jotka johtavat useiden vuosien kuluessa kävelyvaikeuksiin, virtsa- ja ulosteinkontinenssiin, dementiaan ja pseudobulbaariseen halvaukseen (1). Kognitiivinen heikentyminen on toiseksi yleisin kliininen oire. Varhaisin merkki on yleensä toimeenpanokyvyn ja prosessointinopeuden heikkeneminen, jota esiintyy useimmilla yli 35-vuotiailla potilailla, mutta se voi ilmetä jo ensimmäisellä vuosikymmenellä (5). Tämä kognitiivinen heikkeneminen on etenevää, ja se pahenee yleensä toistuvien aivohalvausten myötä, minkä lisäksi heikentyvät välineelliset toiminnot, muisti, kieli, päättelykyky ja visuospatiaaliset kyvyt. Yli 70 prosenttia potilaista on dementoituneita kuudenteen elinvuosikymmeneen mennessä. Vaikea afasia, apraxia tai agnosia ovat CADASILissa harvinaisia.
Psykiatrisia häiriöitä, lähinnä mielialahäiriöitä, esiintyy 20 prosentilla potilaista, yleensä vaikeina masennusjaksoina. Apatiaa esiintyy 40 %:lla potilaista, eikä se liity masennukseen Muita harvinaisempia kliinisiä ilmenemismuotoja ovat akuutti reversiibeli enkefalopatia (6) (10 %:lla potilaista), useimmiten auraoireisen migreenin jälkeen, kouristuskohtaukset (5-10 %:lla potilaista), kuurous, parkinsonismi, aivoverenvuodot (useimmiten potilailla, joilla on kohonnut verenpaine) ja sydäninfarkti.
Täydellisestä penetraatiosta huolimatta CADASILin kliinisen ilmentymisen vaihtelu on merkittävää potilaiden välillä ja sisällä. Samalla NOTCH-3-mutaatiolla on laaja kliininen kirjo, eikä homotsygoottisten ja heterotsygoottisten potilaiden välillä ole selviä eroja. Itse asiassa genotyypin ja kliinisen fenotyypin välillä ei ole korrelaatiota (4). Näiden erojen syytä ei tiedetä, mutta joitakin mahdollisia CADASILin fenotyyppiä muokkaavia tekijöitä on kuvattu, kuten nykyinen tupakointi aivohalvauksen riskin ja ensimmäisen aivohalvauksen iän suhteen, korkea verenpaine aivohalvauksen riskin suhteen tai homokysteiinipitoisuus migreenin alkamisiän suhteen (3,4). Nämä ja muut tekijät voivat vaikuttaa taudin kliiniseen ilmenemiseen muuttamalla geeniekspressiota tai vaikuttamalla muihin fysiopatologisiin reitteihin, jotka voivat johtaa samoihin kliinisiin ilmenemismuotoihin.
Radiologiset muutokset ilmenevät kaikilla henkilöillä, joilla on CADASIL-mutaatio ennen 35 vuoden ikää, ja ne lisääntyvät ajan myötä. Varhaisimpia ja yleisimpiä piirteitä ovat hyperintensiiviset, tehostumattomat pistemäiset alueet aivojen valkeassa aineessa ja subkortikaalisissa rakenteissa magneettikuvauksen T2-painotetuissa ja nesteenpainotteisissa inversioelvytyskuvissa. Ulkokapselien ja ohimolohkojen etuosan osallistuminen on tyypillistä tälle taudille, ja se on johtolanka diagnoosissa, sillä ne auttavat erotusdiagnostiikassa muiden sairauksien, kuten pienten verisuonten taudin, kanssa (1).
CADASILia pidetään yleisesti nuorten ja keski-ikäisten aikuisten sairautena, mutta iäkkäiden potilaiden määrä saattaa olla alidiagnosoitu (7,8). Toinen tapauksemme voi toimia esimerkkinä: 79-vuotias potilas, jolla oli verisuoniperäisiä riskitekijöitä ja toistuvia aivohalvauksia ja jolla oli valkean aineen sairaus, jota useat neurologit pitivät sekundaarisena pienten verisuonten tautina. Diagnoosiin päästiin vasta sen jälkeen, kun hänen tyttärensä mutaatiosta saatiin tieto. Tapauksissa, joissa ei ole selkeää sukuhistoriaa , avoin mieli ja huolellinen huomio viittaaviin radiologisiin löydöksiin, kuten ulkokapselin tai etummaisten ohimolohkojen osallisuuteen, voivat olla ainoa vihje oikean diagnoosin saamiseksi.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: 11 potilaan tapaussarja. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. CADASILin kliininen kirjo ja sydän- ja verisuonitautien riskitekijöiden vaikutus fenotyyppiin: tutkimus 200 peräkkäin rekrytoidulla henkilöllä. Stroke 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. Geneettisten ja kardiovaskulaaristen riskitekijöiden vaikutus CADASIL-fenotyyppiin. Brain. 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepetsiili potilailla, joilla on subkortikaalinen vaskulaarinen kognitiivinen heikentyminen: satunnaistettu kaksoissokkotutkimus CADASILissa. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. ”CADASIL-koma”: alidiagnosoitu akuutti enkefalopatia. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. NOTCH3-mutaation homotsygoottius 65-vuotiaalla CADASIL-potilaalla, jolla oli lieviä oireita: perheraportti. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. CADASILin huomattavan vaihteleva ilmaantuvuus: raportti korkeassa iässä lievästi oireilevasta miehestä. J Neurol. 2009;256:1026-7
Vastaa