- Introduction
- Kokeellinen
- Materiaalit
- Interkalaatioyhdisteiden synteesi
- Charakterisointi
- Tulokset ja keskustelu
- XRD-ominaisuuksien karakterisointi
- FTIR-spektri
- Kaol/alkyyliamiini -interkalaatioyhdisteiden rakennemalli
- Terminen analyysi
- Hajoamisreaktiokinetiikka
- Johtopäätökset
- Tekijän kontribuutiot
- Erittely eturistiriidoista
- Kiitokset
Introduction
Savi-/polymeeri-nanokomposiittien suunnittelu ja valmistus ovat herättäneet suurta kiinnostusta sekä tiede- että insinööriyhteisöissä (Cheng et al., 2017). Erilaisia savi/polymeeri-nanokomposiitteja on kehitetty ja niitä käytetään laajasti (Gogoi ja Raidongia, 2017). Savien esi-interkalointi ja sen jälkeen polymeerien sisällyttäminen savimineraalikerrokseen on laajalti käytetty lähestymistapa savi/polymeeri-nanokomposiittien valmistukseen (Li et al., 2009; Zare et al., 2017). Kun orgaaniset polymeeriketjut interkaloituvat epäorgaanisten savikerrosten sisään, ne vähentävät luonnollisesti rakenteellista liikkuvuuttaan ja osa niistä omaksuu erittäin järjestäytyneen konformaation kerroksellisessa rakenteessa.
Luonnossa kaoliniitti (Kaol) on savimineraalityyppi, jolla on 1:1 dioktaedrinen alumiinisilikaattikerrosrakenne (Brindley ja Robinson, 1945). Kaolin kerroksia pitävät yhdessä vetysidokset, dipoli-dipoli-vuorovaikutukset ja van der Waalsin voimat (Brindley et al., 1967). Kuitenkin vain rajallinen määrä erittäin polaarisia orgaanisia lajeja, kuten urea (Makó et al., 2009), dimetyylisulfoksidi (Costanzo ja Giesse, 1986), formamidi (Frost et al., 2000a), hydratsiini (Cruz ja Franco, 2000) ja kaliumasetaatti (Frost et al., 2000b), on onnistuttu interkaloimaan Kaolin galleriaan. Pienten molekyylien interkaloituminen Kaol-kerroksiin aiheuttaa basaalivälien kasvua, ja sitä voidaan käyttää alustavana laajenemisvaiheena suurikokoisten, ei-reaktiivisten lajien myöhempää lisäystä varten syrjäyttämällä ennalta interkaloituneet pienet molekyylit (Cheng et al., 2015). Esimerkiksi aiempien raporttien perusteella Kaol/metanoli-interkalaatioyhdiste voi olla tehokas välivaihe myöhempää interkalaatioreaktiota varten etyleeniglykolin (Hirsemann et al., 2011), heksyyliamiinin (Matusik et al., 2012), n-alkyyliamiinien (Gardolinski ja Lagaly, 2005) ja kvaternääristen ammoniumsuolojen kanssa (Cheng et al., 2016). Lisäksi suurinta osaa vierasmolekyyleistä on vaikea lisätä kerrosten väliseen tilaan, yksi syy on vahvat vetysidokset, toinen on se, että Kaol-rakenteessa ei ole vaihdettavia ioneja.
Vaikka savi/polymeeri-nanokomposiitteja on kehitetty hyvin viime vuosina, uusien savi/orgaanisten nanokomposiittien syntetisoiminen potentiaalisia käyttökohteita varten on edelleen suuri haaste (Kotal ja Bhowmick, 2015). Tämän ongelman ratkaisemiseksi on todella kiireellistä selvittää kaoliniitin interkalaation nanomittakaavan prosessi ja tehdä perusteellinen tutkimus hajoamismekanismista nykyaikaisen teknologian ja analyyttisten välineiden avulla. Saven ja polymeerin interkalaatioyhdisteiden lämpöanalyysi ja kineettinen laskenta voivat auttaa luonnehtimaan hajoamisprosesseja ja tarjota tieteellisen perustan interkalaatioreaktioiden valvonnalle (Zhang et al., 2015). Hajoamisreaktion kinetiikkaprosessin kineettisiä parametreja, kuten aktivoitumisenergiaa, esieksponentiaalia, reaktiojärjestyksiä ja nopeusvakioita, arvioitiin saven/polymeerin termogrammien tietojen avulla. Tässä tutkimuksessa tutkittiin Kaolin interkalaatiota erilaisten alkyyliamiinien kanssa. Lisäksi interkalaatioprosessia ja hajoamismekanismia tutkittiin systemaattisesti.
Kokeellinen
Materiaalit
Tässä tutkimuksessa käytetty kaoliini hyödynnettiin Zhangjiakouista, Kiinasta. Päämineraalikoostumus on hyvin järjestäytynyt kaoliniitti (95 % massasta). Se jauhettiin siten, että se läpäisi 325-silmäisen seulan (hiukkaset, joiden koko on < 44 μm) ennen interkalaatiota. Alkyyliamiini heksyyliamiini (HA, 99 %), dodekyyliamiini (DA, kemiallisesti puhdas) ja oktadekyyliamiini (OA, kemiallisesti puhdas) ostettiin Nanjing Shuguang Chemical Companysta, Kiina. Dimetyylisulfoksidi (DMSO, analyyttinen reagenssi), metanoli (MeOH, analyyttinen reagenssi) ja tolueeni (99 %) saatiin Xilong Chemical Companyltä, Kiina, ja niitä käytettiin sellaisenaan ilman lisäpuhdistusta. HA:n, DA:n ja OA:n kemiallinen kaava ja rakennekaava on esitetty taulukossa 1.

TAULUKKO 1. HA:n, DA:n ja OA:n kemialliset ja rakennekaavat.
Interkalaatioyhdisteiden synteesi
Ensiksi valmistettiin Kaol/DMSO-interkalaatioyhdiste dispergoimalla 20,0 g Kaolia 36,0 g DMSO:n ja 4,0 g veden seokseen. Seosta sekoitettiin vesihauteessa 2 tuntia 95 °C:ssa, minkä jälkeen suspensio erotettiin sentrifugoimalla etanolilla. Toiseksi Kaol/DMSO-interkalaatioyhdistettä käytettiin esiasteena jatkoreaktiossa MeOH:n kanssa. MeOH lisättiin esi-interkaloituneeseen Kaoliin ja reaktioseosta sekoitettiin 10 päivän ajan siten, että MeOH korvattiin joka päivä samalla määrällä tuoretta MeOH:ta. Seoksen sakka erotettiin sentrifugoimalla ja kuivattiin uunissa 60 °C:ssa 12 tunnin ajan, jolloin saatiin Kaol/MeOH-interkalaatioyhdisteitä. Lopuksi 2 g Kaol/MeOH-interkalaatioyhdistettä sekoitettiin 30,0 ml:aan HA-, DA- tai OA-metanoliliuoksia (1 mol/l) sekoittamalla huoneenlämmössä. Dispersiot sentrifugoitiin reaktion jälkeen 24 h. Sedimentit pestiin kolme kertaa tolueenilla ylimääräisen HA:n, DA:n tai OA:n poistamiseksi. Näytteet kuivattiin huoneenlämmössä 12 h ja jauhettiin jauheiksi akaattimurskalla (Komori et al., 1999). Tuloksena syntyneet yhdisteet on merkitty nimillä Kaolpi/HA (pi esi-interkaloituna), Kaolpi/DA ja Kaolpi/OA.
Charakterisointi
XRD-kuviot kirjattiin Rigaku D/max 2500PC röntgendiffraktometrillä Cu Kα (λ = 1,54178 Å) säteilyllä, joka toimi 40 kV:n ja 150 mA:n teholla. Satunnaisesti orientoituja näytteitä skannattiin 2θ-alueella välillä 1-20° nopeudella 2° min-1. Thermo Fisher Nicolet 6700 -spektrofotometriä käytettiin FTIR-spektrien tallentamiseen alueella 4 000 ~ 400 cm-1. TG-DSC-analyysit tehtiin Mettler-Toledo TG-DSC I/1600 HT simultaanisella lämpöanalysaattorilla typpi-ilmakehässä. Kaksikymmentä milligrammaa näytettä asetettiin alumiinioksidia sisältävään upokkaaseen ja kuumennettiin 30-1 100 °C:sta lämmitysnopeuksilla 4, 6, 8, 8, 10 °C min-1.
Tulokset ja keskustelu
XRD-ominaisuuksien karakterisointi
Kuvassa 1 on esitetty koskemattoman Kaolin ja sen interkalaatioyhdisteiden XRD-kuviot. Alkuperäisen Kaolin kuviossa näkyy hyvin järjestäytynyt kerrosrakenne, jonka basaaliväli on 0,71 nm. Tämä arvo vastaa hyvin ICDD:n standardiviitekuviota 14-0164 . Kun sitä käsiteltiin DMSO:lla, uusi perusheijastushuippu ilmestyi 1,14 nm:n kohdalle, mikä osoittaa, että DMSO oli onnistuneesti lisätty Kaolin välikerroksiin. Kun Kaol/DMSO-interkalaatioyhdiste käsiteltiin MeOH:lla, Kaol/DMSO-interkalaatioyhdisteen 1,14 nm:n (001) heijastusominaisuus siirtyi 0,86 nm:iin. Matusik et al. (2012) raportoivat, että Kaol/DMSO/MeOH-yhdiste kuivattiin 110 °C:ssa, jolloin heijastus, jonka d = 1,12 nm, katosi ja havaittiin laaja heijastus, jonka maksimi oli 0,95 nm:ssä. CHNS-analyysin perusteella lasketun Kaol/DMSO-interkalaatioyhdisteen kemiallisen kaavan Al2Si2O5(OH)3.20(OCH3)0.80 perusteella se osoitti, että noin 1/3 sisäpinnan OH-ryhmistä oli korvattu metoksiryhmillä, ja tämä havainto viittaa myös Kaol/MeOH-interkalaatioyhdisteen muodostumiseen (Tunney ja Detellier, 1996; Cheng et al., 2015). XRD-kuviot osoittavat myös, että HA:n, DA:n ja OA:n kanssa interkaloituneet Kaol/MeOH-yhdisteet laajentavat rakennetta c-akselin suuntaisesti, mikä johtaa suureen kerrosten väliseen etäisyyteen, joka on vastaavasti 2,86, 4,08 ja 5,66 nm. HA-, DA- ja OA-molekyyliketjujen pituudet ovat vastaavasti 1,56, 2,51 ja 3,65 nm (McNulty et al., 2011, 2014). Kaiken kaikkiaan Kaol/alkyyliamiini-interkalaatioyhdisteiden kerrosten välinen etäisyys kasvoi alkyyliamiinien alkyyliketjujen pituuden myötä, mutta alkyyliamiinimolekyyli ei ole yksikerroksinen tai kaksikerroksinen rakenne, joka on kohtisuorassa Kaolin pintaan nähden.
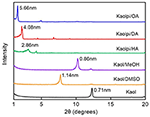
KUVA 1. Kaol-alkyyliamiinin molekyylien välinen etäisyys. Kaolin, Kaol/DMSO:n, Kaol/MeOH:n, Kaolpi/HA:n, Kaolpi/DA:n ja Kaolpi/OA:n XRD-kuviot.
FTIR-spektri
FTIR-spektroskopiaa on käytetty laajalti interkalaatioyhdisteiden karakterisoinnissa (Ledoux ja White, 1964; Frost et al., 2000c; Cheng et al., 2012). Alkuperäisen Kaolin, Kaolpi/HA:n, Kaolpi/DA:n ja Kaolpi/OA:n interkalaatioyhdisteiden FTIR-spektrit on esitetty kuvassa 2. Tyypilliset kaistat 432, 470 ja 541 cm-1 (kuva 2B) kuuluvat Si-O:n, Si-O-Si:n ja Al-O-Si:n deformaatiomoodeihin. Muut kaistat 1 009, 1 031 ja 1 114 cm-1 (kuva 2C) osoitetaan Kaol-kerroksen Si-O-Si:n venytysvärähtelyille. Verrattaessa Kaolin ja sen interkalaatioyhdisteiden spektrejä kaistojen sijainnissa ei ole ilmeistä vaihtelua, mikä osoittaa, että interkaloituneet molekyylit eivät vaikuta näihin venytysvärähtelykaistoihin.
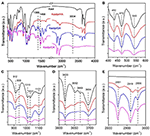
Kuva 2. Kaolin ja sen interkalaatioyhdisteiden spektrit. Kaolin, Kaolpi/HA:n, Kaolpi/DA:n ja Kaolpi/OA:n infrapunaspektrit.
Kaistat 912 ja 938 cm-1:n kohdalla (kuva 2C) kuuluvat sisäisten hydroksyyliryhmien ja sisäpinnan sisäisten hydroksyyliryhmien OH-muodonmuutoksiin. Alkuperäisen Kaolin spektrissä on neljä selvää hydroksyylivenytyskaistaa 3,694, 3,669, 3,652 ja 3,620 cm-1 (kuva 2D). 3,694, 3,669 ja 3,652 cm-1:n kaistat johtuvat sisäpinnan sisäisistä hydroksyyliryhmistä, kun taas 3,620 cm-1:n kaista on seurausta sisäisistä hydroksyyliryhmistä (Farmer, 1964; Ledoux ja White, 1964; Giese ja Datta, 1973). Alkyyliamiinimolekyylien interkalaation jälkeen jotkin kaistat heikkenivät, koska vuorovaikutukset naapuriatomien kanssa muuttuivat. Siirtymä 3 697 cm-1:een ja 3 694 cm-1:n kaistan intensiteetin väheneminen osoittaa, että Kaolin lukuisat hydroksyyliryhmät osallistuivat ja muodostivat vetysidoksia alkyyliamiinimolekyylien amiiniryhmien kanssa (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
Kerrosten väliin jäävien alkyyliamiinimolekyylien läsnäolo havaittiin FTIR-spektrissä uusista piikeistä, jotka on esitetty kuvissa 2A,E. Interkalaatioyhdisteiden osalta jotkut ilmeiset tyypilliset piikit, kuten kaista 1 388 ja 1 468 cm-1:ssä, kuuluvat vastaavasti -CH3:n ja -CH2:n C-H-taivutusmoodiin. Uusi värähtelykaista 3 334 cm-1 havaittiin, joka johtuu N-H-venytysvärähtelyn venytysmoodista (Griffiths ja De Haseth, 2007; Zhang et al., 2018). Havaittiin uusi värähtelykaista 2 956 cm-1:ssä, joka yleensä osoitetaan terminaalisten metyyliryhmien C-H:n epäsymmetriselle venytyskaistalle (Cheng et al., 2016). Kaksi värähtelykaistaa 2,919 ja 2,851 cm-1:ssä osoitetaan yleensä -(CH2)n-:n symmetrisille ja epäsymmetrisille venytysvärähtelyille (Venkataraman ja Vasudevan, 2001). Kaistojen intensiteetti kasvaa vähitellen, mikä tarkoittaa, että Kaol-välikerroksiin on lisätty enemmän alkyyliamiinin hiiliatomeja. Lisäksi alkyyliamiinien haihtuvuus vähenee hiiliketjun kasvaessa, joten vastaavien Kaol-interkalaatioyhdisteiden stabiilisuus kasvaa vähitellen suuremman alkyyliamiinin molekyylimassan kasvaessa (Wang et al., 2010).
Kaol/alkyyliamiini -interkalaatioyhdisteiden rakennemalli
Interkaloituneiden molekyylien sijoittelu on perusta Kaol/alkyyliamiini -interkalaatioyhdisteiden rakenteen kokeelliselle analyysille. Lagalyn (1981) mukaan montmorilloniitti-kvaternaarisen ammoniumsuolan interkalaatioyhdisteiden rakennemallit voidaan jakaa kolmeen luokkaan: (a) monokerrokset: lyhytketjuiset alkyyliamiiniionit; b) kaksikerrokset: pitkäketjuiset kvaternaariset ammoniumionit; c) kolmikerrokset: voimakkaasti varautuneissa savimineraaleissa olevat nivoutuneet alkyyliketjut. Beneke ja Lagaly (1982) ehdottivat lisäksi XRD:n perusteella erilaisia interkaloituneiden alkyyliamiinimolekyylien rakenteita, jotka on tiivistetty seuraavasti: (a) kerrosten välisessä tilassa olevat alkyyliketjut ovat kallistuneet (001)-kiteentasoon nähden; b) alkyyliketjut ovat järjestäytyneet kaksoiskerroksiksi. Brindley ja Moll (1965) kuvasivat, että interkaloituneet molekyylit ovat kallistuneet silikaattilevyihin nähden yksittäisessä kerroksessa, kun taas kulma on noin 65° (001)-kiteentasoon nähden. Jos vuorovaikutuksessa olevat molekyylit kiinnittyvät tasaisesti kaikkiin silikaattipintoihin aktiivisten hydroksyyliryhmien avulla, ehdotetaan ”päästä päähän” -organisaatiota pareittain, jossa on jonkin verran pituussuuntaista siirtymää. Kaltevuuskulma on sopusoinnussa silikaattihapen pintojen ja päätehydroksyyliryhmien välisen mahdollisen tiiviin pakkautumistavan ja ketjumolekyylien keskinäisen tiiviin pakkautumisen asteen kanssa.
Alkyylimolekyylien on vaikea interkaloitua suoraan alkuperäisiin Kaol-kerroksiin, koska Kaolin kerrosten välisestä tilasta puuttuu vaihtokelpoisia ioneja. Kelvolliset esiasteet ovat välttämättömiä, kun alkyyliamiinimolekyylit asettuvat Kaolin välikerrokseen. Raportoitiin, että alkyylitrimetyyliammoniumkloridiketju muodostaa kallistetun kaksoiskerroksen Kaolin välikerroksessa ja kallistuskulma on ~36° laskennan jälkeen (Kuroda et al., 2011). Yuan et al. (2013) huomauttivat, että kvaternääristen ammoniumsuolamolekyylien rakenteellinen järjestely Kaolin välikerroksessa on kallistunut kaksoiskerros ja kallistuskulma on ~38,4°. Gardolinski ja Lagaly (2005) ehdottivat, että kaksoiskerroksen välikerroksen alkyyliketjut ovat täysin venytettyjä ja suuntautuneet kohtisuoraan Kaolin pintaan nähden. Näin ollen HA-, DA- ja OA-molekyyliketjujen pituuksien analysoinnista voidaan tehdä johtopäätös, että interkalaation jälkeinen basaaliväli ei ole riittävä, jotta alkyyliketju pääsisi sisään pystysuoraan ja kaksoiskerroksittain. XRD-tuloksia edelleen analysoimalla voidaan havaita, että HA:n, DA:n ja OA:n alkyyliketjut ovat kallistuneet Kaolin pintaa kohti kaksoiskerroksessa ja alkyyliketjujen kaltevuuskulmat ovat vastaavasti noin 39,9, 39,9 ja 41,1°. Lisäksi Kaolin sisäpinnan hydroksyylin ja alkyyliamiinimolekyylien amiiniryhmien välisen hydroksyylisidoksen vuoksi Kaolin ja alkyyliamiinin interkalaatioyhdisteiden mahdollisin rakennemalli on esitetty kuvassa 3.
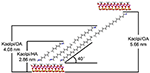
KUVA 3. Kaolin ja alkyyliamiinin interkalaatioyhdisteiden rakenteellinen malli. Kaoliniitti/alkyyliamiini -interkalaatioyhdisteiden mahdollisin rakennemalli.
Terminen analyysi
Kaolin ja sen interkalaatioyhdisteiden TG-DSC-analyysitulokset on esitetty kuvassa 4. Kaolin pääasiallinen massahäviö on 400 ja 600 °C:n välillä, ja suurin häviönopeus 525 °C:n lämpötilassa johtuu veden häviöstä, joka johtuu kideruudun dehydroksylaatiosta, mikä johtaa meta-kaoliniitin muodostumiseen (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Tämä häviö vastaa noin 12,7 % kokonaismassasta, mikä on erittäin lähellä teoreettista viitearvoa (13,9 %). Alkuperäisen Kaolin TG-DSC-käyriä vertailemalla havaitaan, että Kaolpi/HA-, Kaolpi/DA- ja Kaolpi/OA-interkalaatioyhdisteissä on kaksi pääasiallista massahäviötä. Ensimmäinen tapahtui 150 ja 350 °C:n välillä, mikä johtuu interkaloituneiden alkyyliamiinimolekyylien hajoamisesta (Yuan et al., 2013). Toinen tapahtui noin 500 °C:n lämpötilassa, mikä johtuu interkalaatiosta poistetun Kaolin dehydroksylaatiosta. Kaolpi/OA:n osalta osa OA:sta interkaloitui silikaattikerrosten väliseen tilaan muodostaen vakaan interkalaation, mikä voidaan todistaa XRD-kuvion avulla. Jotkin molekyylit ovat kietoutuneet toisiinsa pitkän ketjun tai nanorullissa olevan puristimen vuoksi, jota ei voida täysin poistaa (Li et al., 2015; Liu et al., 2016). Selvä massahäviö 220 °C:ssa johtuu päällystetyn tai sitoutumattoman OA:n hajoamisesta, kun taas massahäviö 330 °C:ssa johtuu interkaloituneen OA:n hajoamisesta. Eksoterminen piikki 996°C:ssa on seurausta Kaolin uudelleenkiteytymisestä.
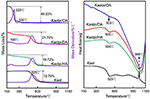
Kuva 4. Kaolin, Kaolpi/HA:n, Kaolpi/DA:n ja Kaolpi/OA:n TG-DSC-käyrät.
Vertailemalla alkuperäisen Kaolin ja Kaol/alkyyliamiini-interkalaatioyhdisteiden (Kaolpi/HA:n, Kaolpi/DA:n ja Kaolpi/OA:n) TG-DSC-käyriä voidaan havaita: (Kaolpi/OA:n ja kahden muun interkalaatioyhdisteen (Kaolpi/HA, Kaolpi/DA) välillä on merkittävä ero massahäviöissä.) Kaolpi/HA:n ja Kaolpi/DA:n hajoamisen massahäviöt olivat noin 20 %, mutta Kaolpi/OA:n kahden massahäviön määrä on noin 50 %. Tämä voi johtua siitä, että suurempi määrä OA:ta oli interkaloitunut silikaattivälikerroksen tilaan kuin HA ja DA (Wang et al., 2017). (b) Interkalaatioyhdisteiden dehydroksylaatiolämpötila oli noin 20 °C alhaisempi kuin alkuperäisen Kaolin lämpötila. Tämä johtuu siitä, että interkalaatiomolekyylit laajensivat kerrosväliä, heikensivät Kaol-kerrosten välisiä vetysidoksia ja saivat aikaan helpomman dehydroksylaation Kaolin pinnalta. Tämän vuoksi Kaolin kiteisyys väheni jyrkästi interkalaation jälkeen, mikä voidaan vahvistaa XRD:llä ja IR:llä (alle 800 cm-1). Tämä tulos on yhdenmukainen joidenkin muiden raporttien johtopäätöksen kanssa, jonka mukaan dehydroksylaatiolämpötila määräytyi Kaolin kiteisyyden mukaan (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Hajoamisreaktiokinetiikka
Kaolin ja alkyyliamiinin interkalaatioyhdisteen hajoamiskinetiikkaa tutkittiin termogravimetriatekniikalla. Hajoamisprosessin kineettiset parametrit (aktivoitumisenergia E ja esieksponentiaalinen tekijä A) laskettiin KAS- ja Ozawa-menetelmien (Kissinger, 1957; Škvára ja Šesták, 1975) perusteella. Kaol/alkyyliamiini-interkalaatioyhdisteen termistä hajoamismekanismia tutkittiin Satava-integraalimenetelmällä (Xie et al., 2001; Gao et al., 2005; Zhang et al.., 2015).
Reaktioteorian mukaan ei-isotermisen hajoamisen kineettinen kaava ilmaistaan yleensä seuraavasti:
missä α on B(s):n muuntumisnopeuden laajuus ajanhetkellä t, f (α) on reaktiomekanismifunktio ja k on reaktionopeusvakio. k noudattaa seuraavaa yhtälöä:
Jos näytteen lämpötilaa kontrolloidaan vakiolämmitysnopeudella (β = dT/dt), reaktionopeus voidaan määritellä seuraavasti:
Muuttujan erottamisen jälkeen järjestämällä uudelleen integraali- tai differentiaalifunktioilla yhtälö (4), KAS-yhtälö (5) ja Ozawan yhtälö (6) voidaan laskea seuraavasti:
Jossa G(α) edustaa muunnoksen integraalifunktiota. Integraalisen approksimaation vuoksi E:n laskemiseen käytettiin iteratiivisia menetelmiä tiettyjen poikkeamien välttämiseksi. Iteratiivisten menetelmien funktiot ovat seuraavat:
Asetetaan x = E/RT, jolloin h(x) ja H(x) määritellään:
Iteraatiot ovat seuraavat kolme vaihetta:
(a) Asetetaan h(x) = 1 tai H(x) = 1, lasketaan E0 pienimmän neliösumman menetelmällä lineaarisen suhteen lnβ/T2 ja lnβ lineaarisen suhteen lineaarisen suhteen kaltevuuden 1/T mukaan.
(c) Korvataan E0 arvolla E1, toistetaan vaihe (b) kunnes Ei-Ei-1 < 0. 1 kJ mol-1. Ei on hajoamisreaktion aktivaatioenergian tarkka arvo.
Kaol/alkyyliamiini-interkalaatioyhdisteiden E-arvot laskettiin KAS-, Ozawa- ja iteratiivisilla menetelmillä (taulukko 2). KAS-menetelmällä saadut lasketut tulokset olivat lähempänä iteratiivisilla menetelmillä saatuja tuloksia, mutta Ozawan iteratiivisella menetelmällä saadut tulokset osoittivat suurempaa poikkeamaa muihin verrattuna. Näin ollen iteratiivisten menetelmien keskimääräistä E:tä voidaan pitää hajoamisreaktion aktivaatioenergiana, koska ne ovat parempi kuin KAS- ja Ozawa-menetelmät. Kaolpi/HA:n, Kaolpi/DA:n ja Kaolpi/OA:n keskimääräiset E:t ovat 104,44, 130,80 ja 154,59 kJ mol-1. Voidaan nähdä, että Kaol/alkyyliamiiniyhdisteiden keskimääräiset E:t korreloivat positiivisesti alkyyliketjun pituuden kanssa. Yksi syy on se, että haihtuvuus heikkenee alkyyliketjun kasvaessa. Toinen syy on se, että Kaolpi/OA:lla on parhaiten järjestäytynyt interkalaatiorakenne, jota on vaikeinta irrottaa interkalaatiosta. Ja nämä tulokset voidaan vahvistaa XRD-kuvioilla.
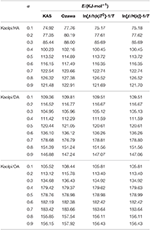
TAULUKKO 2. KAS-, Ozawa- ja iteraatiomenetelmillä lasketut E:t kaoli/alkyyliamiini-interkalaatioyhdisteille eri α:lla.
Hajoamisreaktiomekanismin funktiot ja A:t laskettiin Satava-menetelmillä, jotka kuvattiin seuraavasti:
Substituoimalla α jokaiseen mekanismifunktioon G(α) saadaan lg:n arvo, lineaarinen sovitus lg ja 1/T, joka vastaa lämmitysnopeutta, funktio, jolla on suurin sovitus, voidaan määrittää todennäköisimmäksi mekanismifunktioksi. Ja E:n ja A:n arvot saadaan lineaarisen sovituskäyrän kaltevuuden ja leikkauspisteen avulla.
Kuten taulukosta 3 käy ilmi, Satava-integraalikaavan perusteella valitaan viisi mekanismifunktiota, joiden sovituksen hyvyys on yli 90 %. Vertailemalla näitä viittä funktiota, mekanismifunktiota nro 9 G(α) = 2, jonka hyvyys on noin 97 %, voidaan pitää todennäköisimpänä mekanismifunktiona, ja nro 9 funktion lineaariset sovituskäyrät on esitetty kuvassa 5. E ja A ovat myös hajoamiskinetiikan normaalialueella. Kolmen kaoli/alkyyliamiini-interkalaatioyhdisteen hajoamismekanismifunktiot on esitetty taulukossa 4.

Taulukko 3. Hajoamismekanismifunktiot. Valitut kineettiset mekanismifunktiot arvioituna Satava-integraalimenetelmällä.

Kuva 5. Satava-integraalimenetelmällä arvioidun nro 9-funktion lineaariset sovituskäyrät.

TAULUKKO 4. Kaol/alkyyliamiini-interkalaatioyhdisteiden kineettiset mekanismifunktiot.
Johtopäätökset
Kaol/alkyyliamiini-interkalaatioyhdisteiden mahdollisia rakennemalleja ja hajoamiskinetiikkaa on tutkittu XRD:n, FT-IR:n ja TG-DSC:n avulla. Kaol/MeOH-yhdisteen interkalaatio HA:n, DA:n ja OA:n kanssa laajentaa Kaolin kerrosväliä c-akselia pitkin, mikä johtaa siihen, että hallitseva heijastus näkyy vastaavasti 2,86, 4,08 ja 5,66 nm:ssä. Lisäksi interkalaation jälkeinen basaaliväli ei ole riittävä, jotta alkyyliketju pääsisi sisään pystysuoralla yksikerroksisella ja kaksikerroksisella tavalla. Pääteltiin, että HA:n, DA:n ja OA:n alkyyliketjut ovat kallistuneet Kaolin pintaan kaksikerroksisessa kerroksessa ja alkyyliketjujen kallistuskulma on ~40°.
KAS-, Ozawa- ja iteratiivisten menetelmien perusteella laskettiin Kaolin ja alkyyliamiinin interkalaatioyhdisteiden aktivoitumisenergian E tulokset. Kaolpi/HA:n, Kaolpi/DA:n ja Kaolpi/OA:n keskimääräinen aktivaatioenergia E on 104,44, 130,80 ja 154,59 kJ mol-1. Kaol/alkyyliamiiniyhdisteiden keskimääräinen aktivoitumisenergia E korreloi positiivisesti alkyyliketjun pituuden kanssa. Kaolin/alkyyliamiinin hajoamisprosessin optimoitu mekanismifunktio määritettiin 3D-diffuusioksi integraalifunktion G(α) = 2 avulla. Tämä tutkimus on edullinen savi/orgaanisten nanokomposiittien hajoamismekanismin paremman ymmärtämisen kannalta, minkä lisäksi se antaa inspiraatiota uusien savipohjaisten materiaalien syntetisoimiseksi.
Tekijän kontribuutiot
HC ja QfL suunnittelivat kokeen ja tarkistivat paperin. YZ, QhL ja PX tekivät kokeet ja kirjoittivat paperin. YZ ja QhL osallistuivat tähän työhön yhtä suurella osuudella.
Erittely eturistiriidoista
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Tohtori Luyi Sunille (Kemian- ja biomolekulaaritekniikan laitos ja polymeerien koulutusohjelma, Materiaalitutkimuksen tutkimuslaitos, Connecticutin yliopisto) osoitetaan kiitokset paperin tarkistamisesta. Kirjoittajat kiittävät kiitollisena Kiinan kansallisen luonnontieteellisen säätiön (41602171), Pekingin luonnontieteellisen säätiön (8164062) ja Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing, myöntämästä taloudellisesta tuesta.
Giese, R., ja Datta, P. (1973). Hydroksyyliorientaatio kaoliniitissa, dickiitissä ja nakriitissa. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). Fourier Transform Infrared Spectrometry. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., and Guggenheim, S. (1985). Kaoliniitin dehydroksylaatio. Am. Mineral. 70, 1-2.
Google Scholar
Vastaa