Molekyylidipolimomentit
Molekyyleissä, jotka sisältävät useamman kuin yhden polaarisen sidoksen, molekyylidipolimomentti on vain vektorikombinaatio niistä, joita voidaan pitää yksittäisinä ”sidosdipolimomentteina”. Matemaattisesti dipolimomentit ovat vektoreita; niillä on sekä suuruus että suunta. Molekyylin dipolimomentti on siis molekyylin yksittäisten sidosten dipolimomenttien vektorisumma. Jos yksittäisten sidosten dipolimomentit kumoavat toisensa, nettodipolimomenttia ei ole. Tällainen on tilanne CO2:ssa, joka on lineaarinen molekyyli (kuva \(\PageIndex{1a}\)). CO2:n jokainen C-O-sidos on polaarinen, mutta kokeet osoittavat, että CO2-molekyylillä ei ole dipolimomenttia. Koska CO2:n kaksi C-O-sidoksen dipolia ovat yhtä suuria ja suunnattu 180°:n kulmassa toisiinsa nähden, ne kumoavat toisensa. Tämän seurauksena CO2-molekyylillä ei ole nettodipolimomenttia, vaikka sillä on huomattava varauserotus. Sitä vastoin H2O-molekyyli ei ole lineaarinen (kuva \(\PageIndex{1b}\)); se on taivutettu kolmiulotteisessa avaruudessa, joten dipolimomentit eivät kumoa toisiaan. H2O:n kaltaisella molekyylillä on siis nettodipolimomentti. Odotamme, että negatiivinen varaus keskittyy happiin, joka on elektronegatiivisempi atomi, ja positiivinen varaus kahteen vetyatomiin. Tämä varauksen polarisaatio mahdollistaa H2O:n vetysidoksen muihin polarisoituneisiin tai varautuneisiin lajeihin, kuten muihin vesimolekyyleihin.
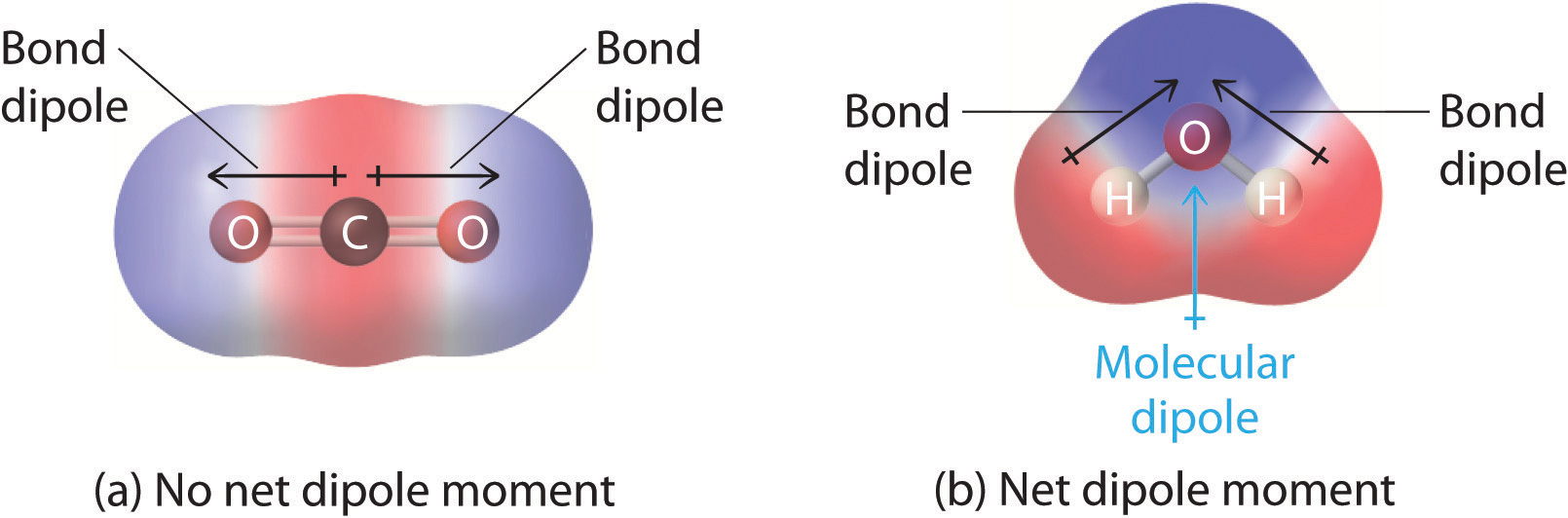
Kuvio \(\PageIndex{1}\): Miten yksittäiset sidosdipolimomentit lasketaan yhteen, jotta saadaan molekyylin kokonaisdipolimomentti kahdelle kolmiatomiselle molekyylille, joilla on erilainen rakenne. (a) CO2:ssa C-O-sidosten dipolit ovat yhtä suuria, mutta suuntautuneet vastakkaisiin suuntiin (180°). Niiden vektorisumma on nolla, joten CO2:lla ei siis ole nettodipolia. (b) H2O:ssa O-H-sidoksen dipolit ovat myös suuruudeltaan yhtä suuret, mutta ne ovat suuntautuneet 104,5°:n kulmassa toisiinsa nähden. Näin ollen vektorisumma ei ole nolla, ja H2O:lla on nettodipolimomentti.
Seuraavassa on yksinkertaistettu yhtälö yksinkertaiselle erotetulle kahden varauksen systeemille, joka esiintyy kaksiatomisissa molekyyleissä tai kun tarkastellaan sidosdipolia molekyylin sisällä.
\
Tämä sidosdipoli, µ (kreik. mu) tulkitaan dipoliksi, joka syntyy varausten erkaantumisesta osittaisvarausten \(Q^+\) ja \(Q^-\) välisellä etäisyydellä \(r\) (tai yleisemmin käytetyillä termeillä \(δ^+\) – \(δ^-\)); dipolin suuntaus on sidoksen akselin suuntainen. Dipolimomenttien yksiköt ovat tyypillisesti debyejä (D), joissa yksi debye vastaa 3,336 x 1030 coulombimetriä (C – m) SI-yksiköissä. Tarkastellaan yksinkertaista järjestelmää, jossa on yksi elektroni ja protoni, jotka on erotettu toisistaan kiinteällä etäisyydellä. \,C \cdot m \label{2} \end{align}\]
\ &= 4.80\; D \label{3} \end{align}\]
\(4.80\; D\) on keskeinen viitearvo ja edustaa puhdasta varausta +1 ja -1, jotka ovat 100 pm:n päässä toisistaan. Jos varauserotusta kuitenkin kasvatettaisiin, niin dipolimomentti kasvaa (lineaarisesti):
- Jos protoni ja elektroni olisivat 120 pm:n päässä toisistaan:
\
- Jos protonin ja elektronin erottaa toisistaan 150 pm:
\
- Jos protonin ja elektronin erottaa toisistaan 200 pm:
\
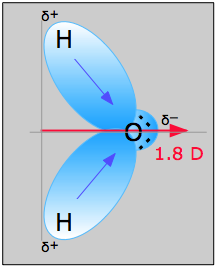
Esimerkkikuvio \(\Sivunindeksi{1}\): Kuvassa \(\PageIndex{1}\) olevan vesimolekyylin avulla voidaan määrittää dipolimomentin suunta ja suuruus. Hapen ja vedyn elektronegatiivisuuksien perusteella ero on 1,2e kummallekin vety-happi-sidokselle. Koska happi on elektronegatiivisempi atomi, sillä on suurempi vetovoima jaettuihin elektroneihin; sillä on myös kaksi yksinäistä elektroniparia. Tästä voidaan päätellä, että dipolimomentti osoittaa kahden vetyatomin välistä kohti happiatomia. Yllä olevan yhtälön avulla dipolimomentin arvoksi saadaan 1,85 D kertomalla happi- ja vetyatomien välinen etäisyys niiden välisellä varauserolla ja etsimällä sitten kummankin komponentit, jotka osoittavat nettodipolimomentin suuntaan (molekyylin kulma on 104.).5˚).
O-H-sidoksen sidosmomentti =1,5 D, joten nettodipolimomentti on
\
Vastaa