Bonding in acetylene
Loppujen lopuksi, hybridiorbitaalien käsite soveltuu hyvin kolmoissidoksisiin ryhmiin, kuten alkyyneihin ja nitriileihin. Tarkastellaan esimerkiksi etyynin (yleisnimi asetyleeni), yksinkertaisimman alkyynin, rakennetta.
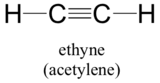
Tämä molekyyli on lineaarinen: kaikki neljä atomia sijaitsevat suorassa linjassa. Hiili-hiili-kolmisidos on vain 1,20Å pitkä. Asetyleenin hybridiorbitaalikuvassa molemmat hiilet ovat sp-hybridisoituneita. Sp-hybridisoituneessa hiilestä 2s-orbitaali yhdistyy 2px-orbitaalin kanssa muodostaen kaksi sp-hybridiorbitaalia, jotka ovat suunnattu 180° kulmassa toisiinsa nähden (esim. x-akselin suuntaisesti). 2py- ja 2pz-orbitaalit pysyvät hybridiytymättöminä ja suuntautuvat vastaavasti kohtisuoraan y- ja z-akselia pitkin.


C-C-sigmasidos muodostuu siis kunkin hiilen yhden sp-orbitaalin päällekkäisyydestä, kun taas kaksi C-H-sigmasidosta muodostuu kunkin hiilen toisen sp-orbitaalin päällekkäisyydestä vedyn 1s-orbitaalin kanssa. Kullakin hiiliatomilla on edelleen kaksi puoliksi täytettyä 2py- ja 2pz-orbitaalia, jotka ovat kohtisuorassa sekä toisiinsa että sigmasidosten muodostamaan linjaan nähden. Nämä kaksi kohtisuoraa p-orbitaaliparia muodostavat kaksi pi-sidosta hiilien välille, jolloin saadaan aikaan kolmoissidos (yksi sigmasidos ja kaksi pi-sidosta).

Hybridiorbitaalien käsite selittää hienosti toisen kokeellisen havainnon: kaksois- ja kolmoissidosten vierekkäiset yksinäissidokset ovat asteittain lyhyempiä ja vahvempia kuin ”tavalliset” yksinäissidokset, kuten yksinkertaisessa alkaanissa. Etaanin hiili-hiilisidos (rakenne A alla) syntyy kahden sp3-orbitaalin päällekkäisyydestä.

Alkiinissa B hiilen ja hiilen välinen yksinäissidos on kuitenkin tulosta sp2-orbitaalin ja sp3-orbitaalin päällekkäisyydestä, kun taas alkiinissa C hiilen ja hiilen välinen yksinäissidos on tulosta sp-orbitaalin ja sp3-orbitaalin päällekkäisyydestä. Nämä kaikki ovat yksinkertaisia sidoksia, mutta sidos molekyylissä C on lyhyempi ja vahvempi kuin sidos molekyylissä B, joka puolestaan on lyhyempi ja vahvempi kuin sidos molekyylissä A.
Selitys tähän on suhteellisen suoraviivainen. Sp-orbitaali koostuu yhdestä s-orbitaalista ja yhdestä p-orbitaalista, ja siten sillä on 50 % s-merkki ja 50 % p-merkki. sp2-orbitaaleilla sen sijaan on 33 % s-merkki ja 67 % p-merkki, kun taas sp3-orbitaaleilla on 25 % s-merkki ja 75 % p-merkki. Pallomaisen muotonsa vuoksi 2s-orbitaalit ovat pienempiä ja pitävät elektronit lähempänä ja ”tiukemmin” ydintä kuin 2p-orbitaalit. Näin ollen sidokset, joihin liittyy sp + sp3 päällekkäisyyttä (kuten alkyni C:ssä), ovat lyhyempiä ja vahvempia kuin sidokset, joihin liittyy sp2 + sp3 päällekkäisyyttä (kuten alkeeni B:ssä). Sidokset, joihin liittyy sp3-sp3-ylitys (kuten alkaani A:ssa), ovat ryhmän pisimpiä ja heikoimmat, koska hybridien p-luonne on 75 %.
Vastaa