Puhtaat aineet ja seokset
Puhdas kemiallinen aine on mikä tahansa aine, jolla on kiinteä kemiallinen koostumus ja ominaispiirteet. Esimerkiksi happi on puhdas kemiallinen aine, joka on väritön ja hajuton kaasu 25 °C:ssa. Hyvin harvat ainenäytteet koostuvat puhtaista aineista; sen sijaan useimmat ovat seoksia, jotka ovat kahden tai useamman puhtaan aineen yhdistelmiä vaihtelevissa suhteissa, joissa yksittäiset aineet säilyttävät identiteettinsä. Ilma, vesijohtovesi, maito, sinihomejuusto, leipä ja lika ovat kaikki seoksia. Jos aineen kaikki osat ovat samassa tilassa, niillä ei ole näkyviä rajoja ja ne ovat kauttaaltaan yhdenmukaisia, aine on homogeeninen. Esimerkkejä homogeenisista seoksista ovat hengittämämme ilma ja juomamme vesijohtovesi. Homogeenisia seoksia kutsutaan myös liuoksiksi. Ilma on siis typen, hapen, vesihöyryn, hiilidioksidin ja useiden muiden kaasujen liuos; vesijohtovesi on useiden aineiden pienten määrien liuos vedessä. Molempien liuosten koostumukset eivät kuitenkaan ole kiinteitä, vaan ne riippuvat sekä lähteestä että paikasta; esimerkiksi Boisen, Idahon osavaltion vesijohtoveden koostumus ei ole sama kuin Buffalon, New Yorkin osavaltion vesijohtoveden koostumus. Vaikka useimmat kohtaamamme liuokset ovat nestemäisiä, liuokset voivat olla myös kiinteitä. Harmaa aine, jota jotkut hammaslääkärit edelleen käyttävät hampaiden reikien täyttämiseen, on monimutkainen kiinteä liuos, joka sisältää 50 prosenttia elohopeaa ja 50 prosenttia jauhetta, joka sisältää pääasiassa hopeaa, tinaa ja kuparia sekä pieniä määriä sinkkiä ja elohopeaa. Kahden tai useamman metallin kiinteitä liuoksia kutsutaan yleisesti seoksiksi.
Jos aineen koostumus ei ole täysin yhtenäinen, se on heterogeeninen (esim. suklaakeksitaikina, sinihomejuusto ja lika). Homogeenisilta vaikuttavat seokset osoittautuvat usein heterogeenisiksi mikroskooppisen tarkastelun jälkeen. Esimerkiksi maito vaikuttaa homogeeniselta, mutta mikroskoopilla tutkittaessa se koostuu selvästi vedessä hajallaan olevista pienistä rasva- ja proteiinirakeista. Heterogeenisten seosten komponentit voidaan yleensä erottaa toisistaan yksinkertaisin keinoin. Kiinteän ja nesteen seokset, kuten hiekka vedessä tai teelehdet teessä, voidaan helposti erottaa toisistaan suodattamalla, jolloin seos ohjataan esteen, esimerkiksi siivilän, läpi, jonka reiät tai huokoset ovat kiinteitä hiukkasia pienempiä. Periaatteessa kahden tai useamman kiinteän aineen seokset, kuten sokeri ja suola, voidaan erottaa toisistaan mikroskooppisella tarkastuksella ja lajittelulla. Yleensä tarvitaan kuitenkin monimutkaisempia toimintoja, esimerkiksi kun kultakimpaleet erotetaan jokisorasta huuhtelemalla. Ensin jokivedestä suodatetaan kiintoainetta, jonka jälkeen kiintoaineet erotetaan tarkastelemalla. Jos kulta on upotettu kiveen, se voidaan joutua eristämään kemiallisin menetelmin.
-and-Milk-(left).jpg?revision=1)
Kuva 1.2.2: Heterogeeninen seos. Mikroskoopilla tarkasteltuna täysmaito on itse asiassa heterogeeninen seos, joka koostuu veteen dispergoituneista rasva- ja proteiinipalloista. Kuva käytetty luvalla Wikipediasta
Homogeeniset seokset (liuokset) voidaan erottaa komponenttiaineisiinsa fysikaalisilla prosesseilla, jotka perustuvat eroihin jossakin fysikaalisessa ominaisuudessa, kuten kiehumispiste-eroihin. Kaksi tällaista erottelumenetelmää ovat tislaus ja kiteytys. Tislauksessa hyödynnetään haihtuvuuseroja eli sitä, kuinka helposti aine muuttuu kaasuksi tietyssä lämpötilassa. Yksinkertainen tislauslaite sellaisten aineiden seoksen erottamiseen, joista ainakin yksi on neste. Haihtuvin komponentti kiehuu ensin ja tiivistyy takaisin nesteeksi vesijäähdytteisessä lauhduttimessa, josta se virtaa vastaanottopulloon. Jos tislataan esimerkiksi suolan ja veden liuosta, haihtuvampi komponentti, puhdas vesi, kerääntyy vastaanottopulloon, kun taas suola jää tislauspulloon.

Kuvio 1.2.3. Suolaliuos: Ruokasuolaliuoksen tislaus veteen. Suolaliuosta vedessä kuumennetaan tislauspullossa, kunnes se kiehuu. Syntyvä höyry rikastuu haihtuvammalla komponentilla (vedellä), joka tiivistyy nesteeksi kylmässä lauhduttimessa ja kerätään sitten vastaanottavaan kolviin.
Kahden tai useamman kiehumispisteeltään erilaisen nesteen seokset voidaan erottaa monimutkaisemmalla tislauslaitteistolla. Yksi esimerkki on raakaöljyn jalostaminen erilaisiksi käyttökelpoisiksi tuotteiksi: lentopolttoaineeksi, bensiiniksi, petroliksi, dieselpolttoaineeksi ja voiteluöljyksi (likimain haihtuvuuden vähenemisjärjestyksessä). Toinen esimerkki on alkoholijuomien, kuten brandyn tai viskin, tislaus. Tämä suhteellisen yksinkertainen menettely aiheutti enemmän kuin vähän päänvaivaa liittovaltion viranomaisille 1920-luvulla kieltolain aikakaudella, jolloin laittomat tislaamot lisääntyivät Yhdysvaltojen syrjäseuduilla.
Kiteytys erottaa seoksia liukoisuuserojen perusteella, eli sen perusteella, kuinka paljon kiinteää ainetta jää liukenemaan tiettyyn määrään tiettyä nestettä. Useimmat aineet liukenevat paremmin korkeammissa lämpötiloissa, joten kahden tai useamman aineen seos voidaan liuottaa korkeassa lämpötilassa ja antaa sen jälkeen jäähtyä hitaasti. Vaihtoehtoisesti nesteen, jota kutsutaan liuottimeksi, voidaan antaa haihtua. Kummassakin tapauksessa liuenneista aineista vähiten liukeneva, eli se, joka vähiten todennäköisesti pysyy liuoksessa, muodostaa yleensä ensin kiteitä, ja nämä kiteet voidaan poistaa jäljelle jäävästä liuoksesta suodattamalla.

Kuvio 1.2.4: Natriumasetaatin kiteytyminen konsentroidusta natriumasetaattiliuoksesta veteen. Pienen ”siemenkiteen” (a) lisääminen saa yhdisteen muodostamaan valkoisia kiteitä, jotka kasvavat ja lopulta valtaavat suurimman osan pullosta. Video löytyy täältä: https://www.youtube.com/watch?v=BLq5NibwV5g
Useimmat seokset voidaan erottaa puhtaiksi aineiksi, jotka voivat olla joko alkuaineita tai yhdisteitä. Alkuaine, kuten harmaa, metallinen natrium, on aine, jota ei voi hajottaa yksinkertaisemmiksi aineiksi kemiallisin muutoksin; yhdiste, kuten valkoinen, kiteinen natriumkloridi, sisältää kahta tai useampaa alkuaineita ja sillä on kemiallisia ja fysikaalisia ominaisuuksia, jotka yleensä eroavat niiden alkuaineiden ominaisuuksista, joista se koostuu. Vain harvoja poikkeuksia lukuun ottamatta tietyllä yhdisteellä on sama alkuainekoostumus (samat alkuaineet samassa suhteessa) riippumatta sen lähteestä tai historiasta. Aineen kemiallinen koostumus muuttuu kemialliseksi muutokseksi kutsutussa prosessissa. Kahden tai useamman alkuaineen, kuten natriumin ja kloorin, muuttuminen kemialliseksi yhdisteeksi, natriumkloridiksi, on esimerkki kemiallisesta muutoksesta, jota usein kutsutaan kemialliseksi reaktioksi. Tällä hetkellä tunnetaan noin 115 alkuainetta, mutta näistä 115 alkuaineesta on valmistettu miljoonia kemiallisia yhdisteitä. Tunnetut alkuaineet on lueteltu jaksollisessa järjestelmässä.
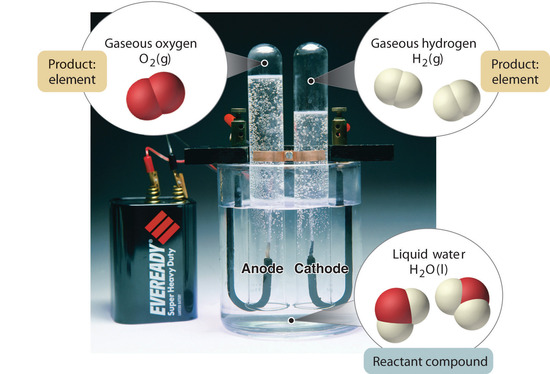
Kuva 1.2.5: Veden hajoaminen vedyksi ja hapeksi elektrolyysin avulla. Vesi on kemiallinen yhdiste; vety ja happi ovat alkuaineita.
Yleisesti käänteinen kemiallinen prosessi hajottaa yhdisteet alkuaineiksi. Esimerkiksi vesi (yhdiste) voidaan hajottaa vedyksi ja hapeksi (molemmat alkuaineita) prosessilla, jota kutsutaanelektrolyysiksi. Elektrolyysissä sähkö tuottaa energian, jota tarvitaan yhdisteen erottamiseen alkuaineisiinsa (kuva 1.2.5). Samanlaista tekniikkaa käytetään laajamittaisesti puhtaan alumiinin, alkuaineen, saamiseksi sen malmista, jotka ovat yhdisteiden seoksia. Koska elektrolyysiin tarvitaan paljon energiaa, sähkökustannukset ovat ylivoimaisesti suurin puhtaan alumiinin valmistukseen liittyvä kustannuserä. Näin ollen alumiinin kierrätys on sekä kustannustehokasta että ekologisesti järkevää. Aineen yleinen järjestäytyminen ja seosten erottamiseen käytettävät menetelmät on esitetty tiivistetysti kuvassa 1.2.6.
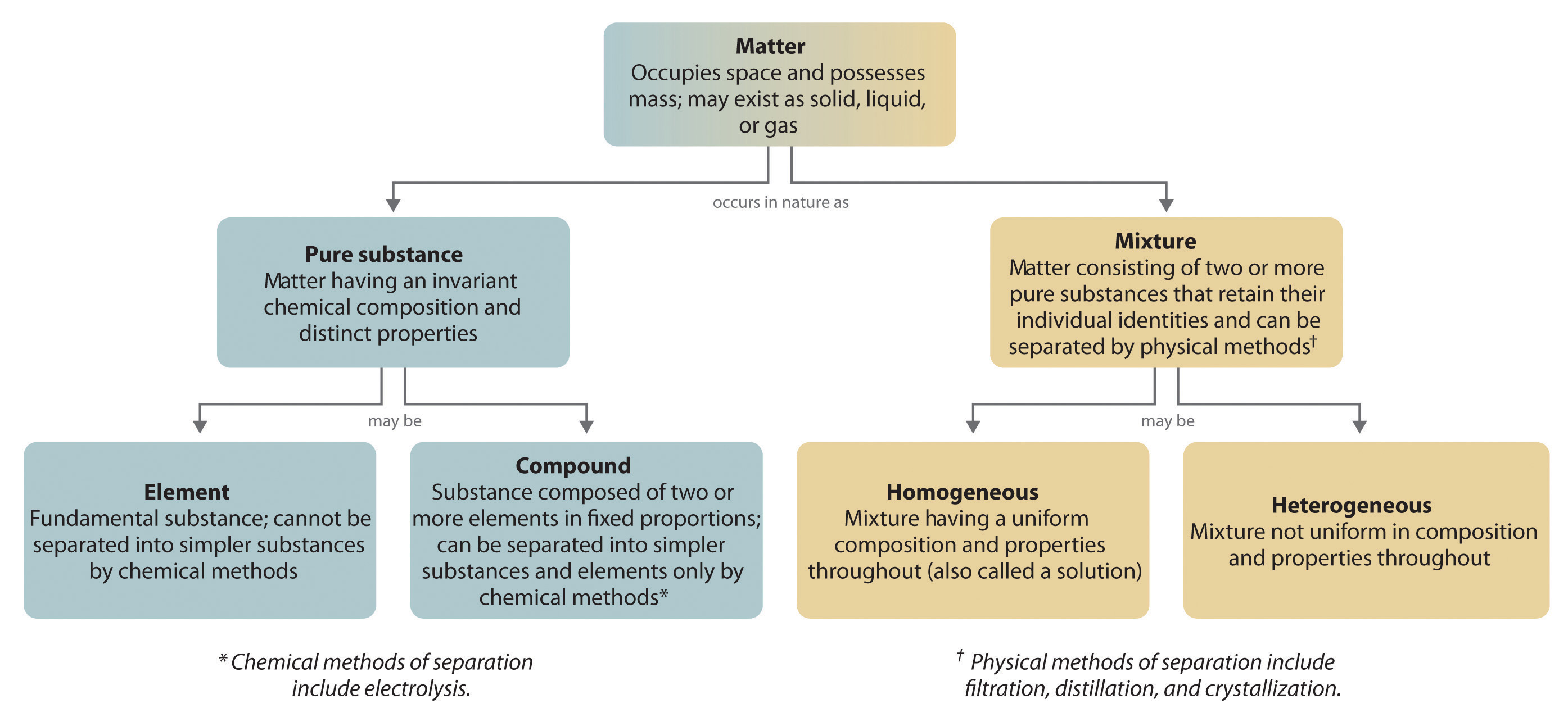
Kuva 1.2.6: Aineen tyyppien ja seosten erottamiseen käytettävien menetelmien väliset suhteet
Esimerkki 1.2.1
Tunnista jokainen aine yhdisteeksi, alkuaineeksi, heterogeeniseksi seokseksi tai homogeeniseksi seokseksi (liuokseksi).
- suodatettua teetä
- tuoreeltaan puristettua appelsiinimehua
- CD-levyä
- alumiinioksidia, valkoista jauhetta, joka sisältää 2:Alumiini- ja happiatomien suhde 3
- selenium
Annettu: kemiallinen aine
Kysytty: sen luokitus
Strategia:
- Päättää, onko aine kemiallisesti puhdas. Jos se on puhdas, aine on joko alkuaine tai yhdiste. Jos aine voidaan erottaa alkuaineisiinsa, se on yhdiste.
- Jos aine ei ole kemiallisesti puhdas, se on joko heterogeeninen seos tai homogeeninen seos. Jos sen koostumus on kauttaaltaan yhtenäinen, se on homogeeninen seos.
Liuos:
- Tee on yhdisteiden liuos veteen, joten se ei ole kemiallisesti puhdas. Se erotetaan yleensä teelehdistä suodattamalla. B Koska liuoksen koostumus on kauttaaltaan yhtenäinen, se on homogeeninen seos.
- A Appelsiinimehu sisältää sekä kiinteitä hiukkasia (hedelmäliha) että nestettä; se ei ole kemiallisesti puhdasta. B Koska sen koostumus ei ole kauttaaltaan tasainen, appelsiinimehu on heterogeeninen seos.
- A CD-levy on kiinteää materiaalia, joka sisältää useampia alkuaineita, ja sen reunoilla on näkyvissä alueita, joiden koostumus on erilainen. Näin ollen CD-levy ei ole kemiallisesti puhdas. B Koostumukseltaan erilaiset alueet osoittavat, että CD-levy on heterogeeninen seos.
- A Alumiinioksidi on yksittäinen, kemiallisesti puhdas yhdiste.
- A Seleeni on yksi tunnetuista alkuaineista.
Harjoitus 1.2.1
Tunnista jokainen aine yhdisteeksi, alkuaineeksi, heterogeeniseksi seokseksi tai homogeeniseksi seokseksi (liuokseksi).
- valkoviini
- elohopea
- ranskalainen salaatinkastike
- pöytäsokeri (sakkaroosi)
Vastaus:
- valkoviini
- elohopea
Vast:
- liuos
- alkuaine
- heterogeeninen seos
- yhdiste
Yhteenveto
Aineita voidaan luokitella fysikaalisten ja kemiallisten ominaisuuksien mukaan. Aine on kaikkea, mikä vie tilaa ja jolla on massaa. Aineen kolme olomuotoa ovat kiinteä, nestemäinen ja kaasu. Fysikaalinen muutos tarkoittaa aineen muuttumista yhdestä olomuodosta toiseen muuttamatta sen kemiallista koostumusta. Suurin osa aineesta koostuu puhtaiden aineiden seoksista, jotka voivat olla homogeenisia (koostumukseltaan yhtenäisiä) tai heterogeenisia (eri alueilla on erilaisia koostumuksia ja ominaisuuksia). Puhtaat aineet voivat olla joko kemiallisia yhdisteitä tai alkuaineita. Yhdisteet voidaan hajottaa alkuaineiksi kemiallisten reaktioiden avulla, mutta alkuaineita ei voida erottaa yksinkertaisemmiksi aineiksi kemiallisin keinoin. Aineiden ominaisuudet voidaan luokitella joko fysikaalisiin tai kemiallisiin ominaisuuksiin. Tutkijat voivat havaita fysikaalisia ominaisuuksia muuttamatta aineen koostumusta, kun taas kemialliset ominaisuudet kuvaavat aineen taipumusta käydä läpi kemiallisia muutoksia (kemiallisia reaktioita), jotka muuttavat sen kemiallista koostumusta. Fysikaaliset ominaisuudet voivat olla intensiivisiä tai laaja-alaisia. Intensiiviset ominaisuudet ovat samat kaikille näytteille, ne eivät riipu näytteen koosta ja niihin kuuluvat esimerkiksi väri, olomuoto sekä sulamis- ja kiehumispisteet. Laajat ominaisuudet riippuvat materiaalin määrästä, ja niihin kuuluvat massa ja tilavuus. Kahden laaja-alaisen ominaisuuden, massan ja tilavuuden, suhde on tärkeä intensiivinen ominaisuus, jota kutsutaan tiheydeksi.
Tekijät
Muokannut Joshua Halpern (Howard University)
Vastaa