Ben Valsler
No es oro todo lo que reluce,
muchas veces has oído decir eso.
Brian Clegg muestra otro lado,
al oro de los tontos – el sulfuro de hierro.
Brian Clegg
‘¡Hay oro en esas colinas!’ ¿O lo hay? Como sugiere su apodo de oro de los tontos, la forma mineral de pirita del disulfuro de hierro II tiene más que un parecido pasajero con el metal precioso. Con la simple fórmula FeS2, la estructura cúbica del compuesto puede dar lugar a la producción de formas platónicas de aspecto notablemente eficaz, tanto en cubos de bordes nítidos como en dodecaedros que parecen haber sido fabricados, aunque más a menudo la formación natural da lugar a una estructura menos claramente demarcada.

Fuente: ©
En los cristales de disulfuro de hierro, los átomos de azufre vienen en pares, con uno de los cuatro enlaces del azufre unido a otro átomo de azufre. Estos enlaces se rompen al calentarse para producir sulfuro de hierro II -FeS- y azufre. Este proceso se utiliza en la producción de dióxido de azufre, tanto para utilizar el gas, por ejemplo, como blanqueador para el papel, como en el primer paso para producir ácido sulfúrico. Más recientemente, el compuesto, que es un semiconductor, ha encontrado un uso en las baterías de litio-hierro, en las que el cátodo está hecho de disulfuro de hierro: estas baterías son compatibles en cuanto a voltaje con las tradicionales de 1,5 voltios, pero duran bastante más que las equivalentes alcalinas.

Fuente: ©
Tal vez la primera aplicación del disulfuro de hierro fue como alternativa al pedernal para hacer saltar chispas -de ahí el nombre de pirita- y a menudo se utilizaba de este modo en las primeras pistolas. También se ha utilizado durante mucho tiempo para producir sulfato de hierro, conocido tradicionalmente como vitriolo verde. El disulfuro de hierro todavía se utiliza a veces de esta manera, aunque con mecanismos más sofisticados que el enfoque tradicional de dejar un montón de pirita al aire libre bajo la lluvia y recoger el líquido que goteaba de él.
Cuando el mineral se oxida, desprende una buena cantidad de calor, lo que puede dar lugar a explosiones en las minas de carbón con un alto contenido de azufre. Esta tendencia a la oxidación no significa, sin embargo, que el disulfuro de hierro II esté siempre encerrado. La pirita pulida se ha utilizado en joyería desde la antigüedad y sus cristales, más bien oscuros (rara vez tienen el brillo del oro), estuvieron especialmente de moda entre finales del siglo XVII y principios del XX.

Fuente: ©
Broche de marcasita
Confusamente, las joyas fabricadas con pirita se denominan joyas de marcasita – confusión que se debe a que existe un mineral alternativo de disulfuro de hierro II llamado marcasita, en el que la estructura cúbica se estira hasta lo que se conoce como forma ortorrómbica. Esta forma es menos adecuada para la fabricación de piedras preciosas, ya que es más frágil y tiende a desmoronarse. El nombre de la joya (a menudo pronunciado «marca-seet» en el Reino Unido) se remonta a una época en la que todas las formas del mineral se conocían como marcasita.

Fuente: ©
Mineral de marcasita
Sin embargo, el disulfuro de hierro II no es en absoluto la única forma de combinar hierro y azufre. El sulfuro de hierro II, de aspecto mucho menos atractivo, es una sustancia negra moteada con una estructura octaédrica alrededor del hierro. El compuesto se forma con bastante frecuencia a partir de la descomposición de material orgánico, ya sea como lodo negro en los pantanos o la decoloración oscura de una yema de huevo demasiado cocida.
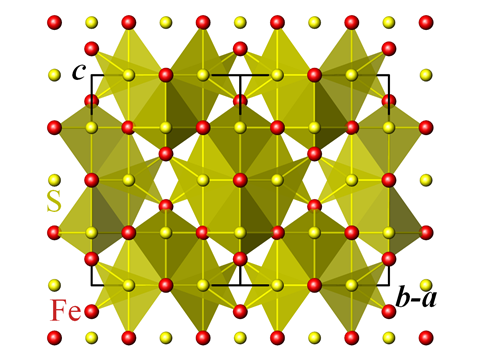
Fuente: Perditax
Estructura cristalina de la greigita
Este es sólo el principio para las variantes sutiles del sulfuro de hierro. Los minerales conocidos como greigita, mackinawita y pirrotita tienen variantes de la estructura, mientras que el polvo negro de sulfuro de hierro III -Fe2S3- sólo se ha producido artificialmente. La greigita está presente en las capacidades de un grupo de bacterias marinas descubiertas en 1975 que tienen la notable capacidad de orientarse según el campo magnético de la Tierra. Denominadas bacterias «magnetotácticas», estos organismos tienen cristales en sus células que son en su mayoría greigita, que es el equivalente en sulfuro de hierro del material magnético natural más conocido, el óxido de hierro magnetita.

Fuente: Raymond T. Downward, NASA
Superficie grabada del meteorito Mundrabilla, mostrando una fase de aleación metálica de hierro y níquel de kamcita (38% de Ni) y taenita (6% de Ni) en la parte inferior derecha, inferior izquierda y superior izquierda. El material más oscuro es un sulfuro de hierro (FeS o troilita) con un precipitado paralelo de duabreelita (sulfuro de hierro y cromo (FeCr2S4).
Quizás la más interesante de las estructuras alternativas sea la troilita, otra forma de sulfuro de hierro con estructura hexagonal. Aunque se encuentra ocasionalmente en la Tierra, lo más frecuente es que aparezca en los meteoritos, concretamente en las variedades relativamente poco comunes que se originaron en la Luna y Marte antes de ser expulsadas de la superficie en un impacto desde el espacio.

El nombre de troilita se dio en honor al sacerdote italiano Domenico Troili, que realizó la primera observación registrada de un meteorito que impactó contra el suelo en 1766. Troili pensó que el material principal del meteorito era marcasita (probablemente significa pirita), pero casi 100 años después el mineralogista alemán Gustav Rose identificó la composición del meteorito como un sulfuro de hierro diferente y le dio el nombre de Troili.
El sulfuro de hierro puede ser un dolor. Puede acumularse, por ejemplo, en los pozos de petróleo y gas, engrosando las tuberías. Sin embargo, en otros lugares ha demostrado su utilidad. Puede ser un simple compuesto de dos elementos químicos sencillos, y como la pirita un falso oro engañoso, pero en sus variadas formas muestra una diversidad y adaptabilidad que hace que sus usuarios sean cualquier cosa menos tontos.
Ben Valsler
Ese fue Brian Clegg en defensa del sulfuro de hierro. La próxima semana, Mike Freemantle con el queroseno, y una forma no convencional de guerra.
Michael Freemantle
Alrededor de un mes después del ataque japonés a Pearl Harbor en diciembre de 1941, un dentista estadounidense ideó un plan para demoler las ciudades japonesas atando pequeñas bombas incendiarias a los murciélagos.
Ben Valsler
Averigua lo que pasó en el Proyecto Rayos X la próxima vez. Hasta entonces, puedes enviar un correo electrónico a [email protected] o un tweet a @chemistryworld si tienes alguna petición de compuestos que debamos incluir en el podcast. Soy Ben Valsler, gracias por acompañarme.
Deja una respuesta