De Proteopedia
proteopedia linkproteopedia link
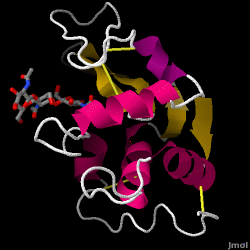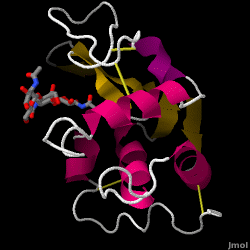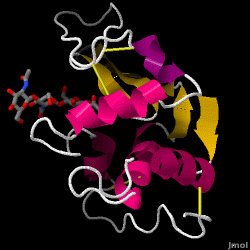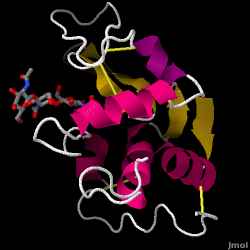
La lisozima -también conocida como muramidasa- es una potente enzima que se encuentra en abundancia en las lágrimas, la saliva y la leche humana. En los humanos, está codificada en el gen LYZ. Dado que se trata de una proteína pequeña, fácilmente disponible y muy estable, ha sido objeto de amplias investigaciones sobre su función y estructura.
Introducción
La lisozima actúa como defensa inespecífica contra bacterias y hongos. Es un componente del sistema inmunitario innato, y es una parte importante de la dieta del lactante para evitar la diarrea. Es una enzima conocida por su capacidad para degradar la arquitectura de polisacáridos de muchos tipos de paredes celulares, normalmente con el fin de protegerse contra las infecciones bacterianas. La estructura de la lisozima de la clara de huevo de gallina (HEW), en la que se centra este artículo, se muestra a la derecha. La actividad antibacteriana de la clara de huevo de gallina fue descrita por primera vez por Laschtschenko en 1909. Fue caracterizada y bautizada como «lisozima» por Alexander Fleming, la misma persona a la que se atribuye el descubrimiento de la penicilina. El descubrimiento de la actividad enzimática fue accidental; durante un experimento no relacionado, se introdujeron inadvertidamente goteos nasales en una placa de Petri que contenía un cultivo bacteriano, cuyo cultivo exhibió en consecuencia los resultados de una reacción enzimática aún desconocida. La observación de esta reacción desconocida condujo a nuevas investigaciones sobre los componentes de esta reacción, así como a la correspondiente identificación de la recién descubierta «lisozima». En 1965, David C. Phillips y sus colaboradores determinaron la estructura tridimensional de la lisozima con una resolución de 2 Å . El trabajo de Phillips fue especialmente innovador, ya que había conseguido dilucidar con éxito la estructura de una enzima mediante cristalografía de rayos X, una hazaña que nunca antes se había logrado. La investigación de Phillips también condujo a una hipótesis basada en la estructura de su mecanismo de acción.
Función
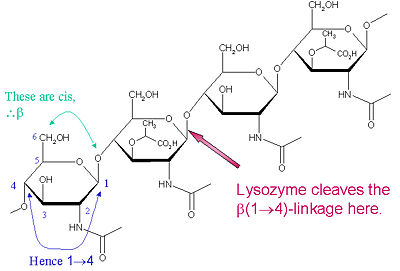
El sustrato particular de preferencia para este tipo de escisión es un (NAG-NAM)₃ hexasacárido, dentro del cual se produce el enlace glicosídico objetivo de escisión, NAM₄-β-O-NAG₅. Las unidades individuales de unión del hexasacárido se designan A-F, con la preferencia de escisión del enlace glicosídico NAM₄-β-O-NAG₅ correspondiente a un enlace glicosídico de la unidad D-E cl
La lisozima es conocida por dañar las paredes celulares bacterianas al catalizar la hidrólisis de los enlaces 1,4-beta-enlaces entre el ácido N-acetilmurámico (NAM) y los residuos de N-acetil-D-glucosamina (NAG) en el peptidoglicano, y entre los residuos de N-acetil-D-glucosamina en las quitodextrinas. De este modo, la lisozima es eficaz para lisar las paredes celulares tanto de bacterias como de hongos. El lugar de corte de la lisozima en este tema arquitectónico es el enlace β(1-4) glicosídico que conecta el carbono C1 de la NAM con el carbono C4 de la NAG.
El sustrato particular de preferencia para este tipo de escisión es un (NAG-NAM)₃ hexasacárido, dentro de cuyo sustrato se produce el enlace glicosídico objetivo de escisión, NAM₄-β-O-NAG₅. Las unidades individuales de unión del hexasacárido se designan de la A a la F, y la preferencia de escisión del enlace glicosídico NAM₄-β-O-NAG₅ corresponde a una preferencia de escisión del enlace glicosídico de la unidad D-E. Dependiendo del organismo del que se obtiene la lisozima, la hidrólisis del enlace glicosídico procede con retención de la configuración en el carbono anomérico (clara de huevo de gallina) o con inversión (oca, fago T4).
La lisozima actúa eficazmente sobre polímeros largos (NAG-NAM) o (NAG). A medida que la longitud de la cadena se hace más pequeña que seis monómeros, las tasas catalíticas caen sustancialmente; de hecho, los trisacáridos actúan como inhibidores competitivos al unirse al sitio activo en un registro no productivo.
Lisozima de clara de huevo (código PDB 1hew)
Mecanismo
La hidrólisis de los enlaces glicosídicos por la lisozima de la clara de huevo de gallina procede con retención de la configuración. En 1953, Koshland sugirió que, en general, la retención de la configuración implica un mecanismo de doble desplazamiento (mientras que la inversión de la configuración implica un desplazamiento simple). Durante décadas, se consideraron dos hipótesis mecanicistas contrapuestas (Phillips: mecanismo disociativo con intermedio de oxocarbenio; Koshland: mecanismo asociativo de dos pasos con un complejo enzimático covalente como intermedio), y los datos de 2001 inclinan la balanza hacia la existencia de un intermedio covalente. La ausencia de una estructura de complejo de sustrato contribuyó sin duda a dificultar la distinción entre los posibles mecanismos, al igual que la existencia de dos mecanismos distintos (retención e inversión de la configuración) dentro de la misma familia estructural de enzimas (p. ej. enzima de gallina frente a la de ganso).
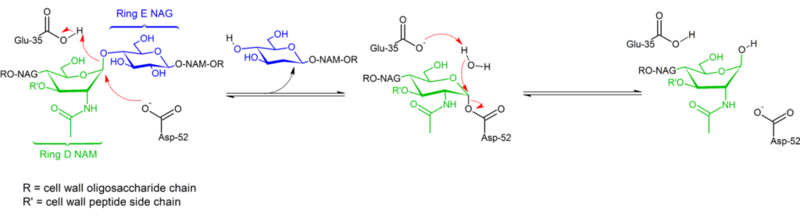
La lisozima hidroliza un glucósido (de ahí la clasificación familiar de la lisozima como glicosilasa), lo que corresponde a la conversión de un acetal en un hemiacetal. La reacción procede en dos pasos, como se muestra en la figura anterior. En el primer paso, Asp 52 actúa como nucleófilo y parte del azúcar es el grupo saliente. En el segundo paso, el agua actúa como nucleófilo y el Asp 52 actúa como grupo saliente. Ambos pasos invierten la configuración en el carbono anomérico, dando lugar a una retención global de la configuración. Glu 35 actúa como un ácido en el primer paso (protonando el azúcar el enlace glicosídico para hacerlo un mejor electrófilo) y como una base en el segundo paso (desprotonando el agua para hacerlo un mejor nucleófilo). Aunque la figura muestra algunos de los azúcares en una conformación de barco para enfatizar la inversión de la configuración, éstos no se observan experimentalmente sino que se encuentran en una conformación de silla.
Aplicaciones de la lisozima
Dado que la lisozima ha sido ampliamente reconocida por sus propiedades antibacterianas y antifúngicas, tiene una amplia variedad de usos tanto en aplicaciones bioquímicas como farmacéuticas. En biología molecular, la lisozima se utiliza a menudo en el procedimiento de lisis alcalina para extraer y aislar ADN plasmídico. Se utiliza mucho en el campo farmacéutico para destruir bacterias grampositivas, y puede utilizarse para apoyar las defensas inmunitarias ya existentes para combatir las infecciones bacterianas. Esta enzima es especialmente importante para prevenir las enfermedades bacterianas en los bebés. Debido a sus propiedades antibacterianas, la lisozima también puede utilizarse en la industria alimentaria para ayudar a prevenir el deterioro de los alimentos.
Véase también
- Estructuras tridimensionales de la lisozima
- Lisozima
- Retención de glicósido hidrolasas
- Parque Infantil Molecular/Lisozima
- Usuario:Judy Voet/Lysozyme
- Lysozyme (árabe)
- Lysozyme (hebreo)
- Ragland SA, Criss AK. De la matanza bacteriana a la modulación inmunitaria: Recientes conocimientos sobre las funciones de la lisozima. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(Londres),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Estructura de la lisozima de la clara de huevo de gallina. Una síntesis tridimensional de Fourier a 2 Angstrom de resolución. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. An Introduction to Enzyme and Coenzyme Chemistry. Blackwell Science Ltd., Oxford
- Soluciones más tempranas para estructuras cristalinas macromoleculares.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Estudios cristalográficos de la actividad de la lisozima de la clara de huevo de gallina. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Imagen de: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Primeros dibujos de cinta de las proteínas. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure of hen egg-white lysozyme. Una síntesis tridimensional de Fourier a 2 Angstrom de resolución. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Estructura de algunos complejos cristalinos de lisozima-inhibidor determinado por el análisis de rayos X en la resolución de 6 Angstrom. Nature. 1965 Mayo 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers y Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATÁLISIS/B._Mecanismos_de_reacciones_catalizadas_por_enzimas/B2.__Lisozima
Página de Proteopedia Colaboradores y editores (¿qué es esto?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
Deja una respuesta