LA REGIÓN BUCAL – UNA VÍA VENTAJOSA PARA LA ADMINISTRACIÓN DE FÁRMACOS
Las innovaciones en la administración de fármacos prometen minimizar los efectos secundarios dependientes de la dosis y maximizar la actividad biológica, al tiempo que mejoran la adherencia del paciente.
La administración oral de fármacos, la vía preferida de administración de fármacos en términos de experiencia del paciente, tiene varias desventajas, como el metabolismo de primer paso hepático, un inicio de acción más largo y la degradación enzimática de los fármacos dentro del tracto gastrointestinal (GI). Cuando la degradación gastrointestinal y hepática limitan la seguridad o la eficacia de un fármaco, las inyecciones invasivas suelen ser el único modo de administración viable, con la consecuencia potencial de una menor adherencia del paciente.

La administración bucal puede lograr efectos locales y sistémicos y es atractiva porque supera las deficiencias de la administración peroral. En efecto, las sustancias absorbidas a través de la mucosa bucal evitan la degradación enzimática gastrointestinal y el efecto de primer paso hepático. Además, la administración bucal representa una alternativa mejor que las inyecciones o los comprimidos para aquellos pacientes que tienen dificultades para tragar.
¿Qué es la zona bucal?
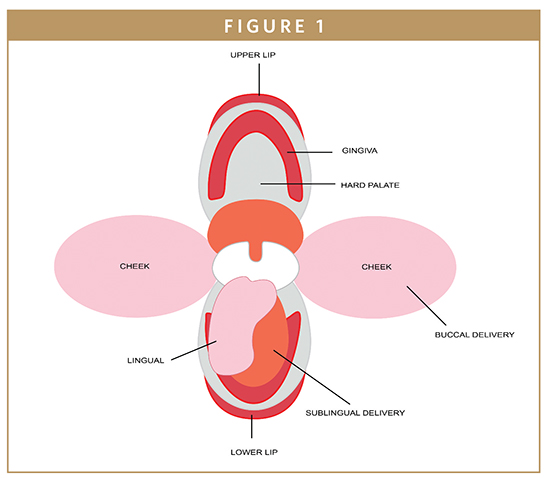
La zona bucal es el revestimiento interior de la mejilla y el labio, y representa aproximadamente un tercio de la superficie de la cavidad oral (Figura 1).1 La mucosa bucal está formada por una capa superficial de epitelio escamoso estratificado unida al tejido conectivo subyacente por una lámina basal. En el tejido conjuntivo hay una red de capilares sanguíneos por los que los fármacos que han permeado a través del epitelio pueden entrar en la circulación sistémica a través de la vena yugular interna.2
El epitelio bucal actúa como barrera para la permeación de los fármacos hidrófilos, mientras que el tejido conjuntivo, de naturaleza más hidrófila, parece afectar al tiempo de retardo difusional de los compuestos lipofílicos.3 El transporte de fármacos a través de la mucosa puede ser transcelular o paracelular (Figura 2); la mayoría de los fármacos hidrofílicos y las macromoléculas permean mediante difusión paracelular pasiva y los compuestos lipofílicos y las pequeñas moléculas hidrofóbicas pasan predominantemente por transporte paracelular.4 Así, la membrana celular actúa como la principal barrera de transporte para los compuestos hidrofílicos, y los espacios intercelulares suponen la principal barrera de permeación de los compuestos lipofílicos.

La importancia de la mucoadhesión
La mucoadhesión se produce cuando dos superficies, una de las cuales es una membrana mucosa, se adhieren entre sí. Es un parámetro crítico para la administración bucal y para la selección de materiales de formulación con propiedades adhesivas óptimas. La mucoadhesión se produce en dos fases: la de contacto y la de consolidación, cuando se establecen las interacciones adhesivas. Es probable que haya múltiples mecanismos en juego que causen la adhesión. Es importante destacar que el fracaso de la unión adhesiva se producirá como resultado de la sobrehidratación de una forma de dosificación, o como resultado de la rotación del epitelio o de la mucosa. Se ha estimado que el tiempo de recambio del epitelio bucal es de 3 a 8 días, en comparación con unos 30 días para la piel.4

Ventajas del lugar
Además de la principal ventaja de la administración sistémica que evita la degradación hepática e intestinal para una mayor biodisponibilidad y menores efectos secundarios, la boca tiene una superficie relativamente grande para la aplicación del fármaco y una buena accesibilidad en comparación con la nariz, el recto y la vagina.5 Asimismo, el rápido recambio celular en la mucosa bucal reduce el riesgo de daño o irritación de los tejidos.6 Aunque la mucosa sublingual es más permeable, vascularizada y fina que la bucal, la superficie de esta mucosa es más pequeña, está constantemente lavada por la saliva y el cizallamiento ejercido por la lengua dificulta el mantenimiento de la forma farmacéutica en contacto con la mucosa sublingual.7 Por todas estas razones, la mucosa de la mejilla es el lugar preferido dentro de la cavidad oral para la administración de sistemas de liberación controlada que necesitan adherirse durante un periodo de tiempo prolongado.8
Limitaciones del lugar
Aumentar la tasa de absorbencia (μg/mm2/s) o la permeabilidad del tejido bucal es a menudo necesario para compensar la limitada superficie disponible. El uso de potenciadores de la permeabilidad (es decir, sustancias que reorganizan la epidermis o las estructuras epiteliales o abren las uniones estrechas intercelulares) es muy importante en este ámbito. Las macromoléculas son más complejas de administrar a través de la mucosa debido a la degradación enzimática de la saliva y a la escasa permeabilidad a través del epitelio bucal sin potenciadores de permeación de base química y eléctrica.9 El uso inadecuado de potenciadores de la permeabilidad puede causar problemas de seguridad en cuanto a la irritación de los tejidos locales, pero también como resultado de un efecto de bolo no deseado que eleva la concentración del fármaco en la sangre a niveles que no son seguros.
Una estrategia alternativa para asegurar una mayor absorción de los fármacos poco solubles o permeables en el tejido es aumentar el tiempo de permanencia en la boca. Al igual que ocurre con los potenciadores de la permeabilidad, el aumento del tiempo de permanencia puede causar irritación de los tejidos, así como molestias al paciente, y requiere una evaluación cuidadosa de los efectos inmediatos y a largo plazo sobre la integridad y la funcionalidad de los tejidos. Aumentar el tiempo de permanencia en la cavidad oral puede suponer un reto adicional, ya que el fármaco puede eliminarse rápidamente debido a la acción de lavado de la saliva. En consecuencia, pueden ser necesarias dosis repetidas y frecuentes, a menos que la forma farmacéutica cree una fuerte unión con la mucosa absorbente. Es necesario investigar para cuantificar en qué medida el lavado salival afecta a la eficacia de la administración oral transmucosa de diferentes sistemas de administración de fármacos.
Es importante tener en cuenta los factores humanos al desarrollar un producto bucal. Dado que la mucosa bucal se extiende desde los espacios superior e inferior entre las mejillas, los labios y las encías, el lugar preciso en el que el paciente coloca la forma farmacéutica puede afectar a la adherencia y absorción del fármaco, y estas implicaciones de los factores humanos pueden afectar a la variabilidad entre pacientes. La forma de colocar la forma farmacéutica puede causar complicaciones adicionales cuando la forma farmacéutica está diseñada para una liberación unidireccional y tiene una cara adhesiva específica para ser colocada contra la parte interna de la mejilla. Por último, cuándo y qué come, bebe o fuma el paciente puede afectar aún más a la absorción del fármaco a través de la mucosa.
El riesgo de desprendimiento y la variabilidad del paciente debido a la estimulación de la saliva pueden minimizarse si el fármaco se administra durante la noche, por ejemplo, cuando el paciente no come ni habla.
Formas de dosificación bucal
Aunque la mucosa bucal sólo se está estudiando ampliamente como una nueva vía de administración de fármacos, su potencial para la administración de fármacos es conocido por la humanidad desde hace siglos. Los nativos americanos introdujeron el tabaco de mascar a los colonos europeos en el siglo XVI, y los recolectores peruanos masticaban hojas de coca hace 8.000 años. La mucosa bucal ha sido objeto de formas de dosificación convencionales, como comprimidos, troqueles y pastillas, y colutorios y sprays, y actualmente hay varios productos de este tipo en el mercado. El reto consiste en mantener estas formas de dosificación en el lugar de absorción, la precisión de la dosificación (líquidos) y la incomodidad (comprimidos). Los comprimidos pueden separarse de la mucosa, tragarse y adherirse a la pared del esófago, lo que supone un riesgo de asfixia, especialmente para los niños y los ancianos.
Se están desarrollando sistemas de administración de fármacos más avanzados, como películas, parches, comprimidos bicapa, hidrogeles y cintas, junto con el uso de micro y nanopartículas, para superar las limitaciones de las formas farmacéuticas convencionales.
Las películas para la administración bucal – CUREFILM
Las películas mucoadhesivas son una forma de dosificación preferida para la administración en la mucosa bucal dada su flexibilidad, comodidad, palatabilidad y tamaño ajustable. Han demostrado un mejor cumplimiento por parte del paciente en comparación con los comprimidos adhesivos.10,11 A diferencia de las formulaciones líquidas, en gel y en pomada, las películas mucoadhesivas permanecen en contacto con la mucosa durante más tiempo, cubren una mayor superficie y, por lo tanto, proporcionan una dosificación más precisa del fármaco.12 De hecho, las películas mucoadhesivas pueden diseñarse mediante una cuidadosa selección del material para mantener un amplio contacto adhesivo con la membrana de la mucosa, prolongando el tiempo de retención del sistema de administración para aumentar la absorción total del fármaco. Además, las películas mucoadhesivas son muy adecuadas para la terapia local, protegiendo las superficies de las heridas orales de la infección, por ejemplo.13
Las composiciones de las películas están diseñadas para conseguir las siguientes propiedades físicas: fuerza bioadhesiva, resistencia a la tracción, flexibilidad y desintegración prolongada. Estas propiedades son fundamentales para lograr el perfil de liberación del fármaco objetivo, la aceptación del paciente y la compatibilidad con los procesos de fabricación comerciales. La consecución de las especificaciones deseadas de las películas poliméricas bucales depende en gran medida del tipo y la concentración de los polímeros seleccionados y de la dosis de principios activos que se administren.
Como se ha comentado aquí, incluso con una película fuertemente adhesiva, el flujo salival hará que parte de la película se disuelva en la cavidad oral y se trague. Las películas de doble capa con una capa posterior oclusiva se han diseñado para impulsar la liberación y absorción unidireccional del fármaco en la mucosa bucal y pueden suministrar altas dosis de principio activo. Aunque estos diseños pueden mejorar la absorción bucal, presentan varios inconvenientes. Pueden dar lugar a errores del usuario en su aplicación, la capa oclusiva puede desprenderse y convertirse en un peligro de asfixia y, por último, la complejidad de la ampliación de una película de doble capa aumenta los costes de fabricación.
Teniendo en cuenta estas limitaciones, el enfoque de CURE Pharmaceutical para el desarrollo de películas bucales con CUREfilm aprovecha el inevitable flujo salival de una película de una sola capa para crear mejores perfiles de liberación de fármacos. Diseñamos nuestros productos para combinar el efecto de bolo de inicio rápido de la administración bucal con la liberación prolongada de la administración gastrointestinal para lograr un perfil general de liberación pulsátil o sostenida. De hecho, con la administración bucal, los niveles en sangre pueden alcanzar un pico rápidamente, y una vida media más corta puede significar que el efecto desaparezca rápidamente. Además, si se administran dosis elevadas de un fármaco únicamente por vía bucal (por ejemplo, más de 100 mg), la concentración tisular local podría ser demasiado elevada y dañar el tejido. Es preferible un enfoque de una sola capa, ya que minimiza los costes y los errores del usuario.
Para crear un CUREfilm bucal, se combina una mezcla cuidadosamente seleccionada de polímeros, potenciadores de la permeabilidad y lípidos para optimizar la adherencia, la difusión del fármaco y la permeabilidad a través de la mucosa. Los lípidos desempeñan un papel crucial en la solubilización y la estabilidad de los principios activos. Ayudan a impulsar los compuestos hidrofílicos a través del epitelio de la mucosa y promueven el transporte transcelular de los compuestos lipofílicos a través del epitelio para llegar a los vasos sanguíneos. La nanoparticulación del principio activo puede proporcionar una flecha adicional en el carcaj del formulador para aumentar la tasa de absorción.
Para lograr una protección gástrica suficiente y una liberación intestinal eficiente de la porción de fármaco que se ingiere, las partículas de fármaco pueden estar total o parcialmente encapsuladas, con recubrimiento entérico o reticuladas a polímeros, como el quitosano, antes de su incorporación a la matriz de la película. Otras estrategias incluyen la formación liposomal o micelar, la cocristalización y el uso de polímeros gelificantes o hinchables.
Esta estrategia dual puede ser muy útil para fármacos combinados con diferentes perfiles metabólicos en los que un fármaco se prepara para la absorción bucal (es decir, si tiene un alto efecto de primer paso), y el otro se prepara para la liberación en el GI.
Resumen
El diseño y la construcción reales de una película oral capaz de una administración terapéutica eficaz pueden ser un reto y requieren la creación de nuevas tecnologías. Como resultado de estas innovaciones, las películas bucales son ahora una forma de dosificación comercialmente viable que puede resolver muchos problemas a los que se enfrentan la industria farmacéutica, los pacientes y sus cuidadores. Podrán sustituir a las inyecciones diarias, como las de apomorfina que toman los pacientes que padecen la enfermedad de Parkinson. Pueden mejorar la biodisponibilidad de los medicamentos, como los cannabinoides, reduciendo potencialmente su dosis y sus efectos secundarios psicoactivos. Cuando se necesita un alivio rápido de los síntomas, pueden proporcionar un efecto en bolo. Son una alternativa cómoda a los líquidos poco apetecibles para los niños y a los comprimidos difíciles de tragar para los ancianos.
Dada la importante necesidad de mercado no satisfecha que abordan, el índice de adopción de las películas orales ha sido elevado. De hecho, el mercado mundial se valoró en 2.100 millones de dólares en 2017 y se prevé que se expanda a una CAGR del 13% durante el periodo de previsión de 2018 a 2026.14 Este crecimiento comercial de las películas orales, incluidas las películas bucales, refleja el creciente enfoque de la industria farmacéutica en la innovación centrada en el paciente en el desarrollo de nuevos medicamentos y la mejora de los antiguos, donde la experiencia del paciente impulsa el diseño de la administración de medicamentos, lo que a su vez mejora los resultados de los pacientes.
- Curatolo W. The lipoidal permeability barriers of the skin and alimentary tract. Pharm Res. 1987;4(4):271-277.
- Colombo P, Cagnani S, Buttini F, Santi P, et al. Biological In Vitro Models for Absorption by Non-Oral Routes, Reference Module in Chemistry, Molecular Sciences and Chemical Engineering, Elsevier. 2013.
- Kulkarni U, Mahalingam R, Pather SI, Li X, Jasti B. Porcine buccal mucosa as an in vitro model: relative contribution of epithelium and connective tissue as permeability barriers. J Pharm Sci. 2009;98(2):471-483. doi: 10.1002/jps.21436.
- Gandhi RB, Robinson JR. Oral cavity as a site for bioadhesive drug delivery Adv Drug Deliv Rev. 1994;13:43-74.
- Rathbone MJ, Drummond BK, Tucker IG. The oral cavity as a site for systemic drug delivery Adv Drug Deliv Rev. 1994;13:1-22.
- Squier CA, Wertz PW. Structure and Function of the Oral Mucosa and Implications for Drug Delivery M.J. Rathbone (Ed.), Oral Mucosal Drug Delivery, Marcel Dekker, New York. 1996:1-26.
- Madhav NVS, Shakya AK, Shakya P, Singh K. Orotransmucosal drug delivery systems: a review. J Control Release. 2009;140:2-11.
- Madhav NVS, Shakya AK, Shakya P, Singh K. Orotransmucosal drug delivery systems: a review J Control Release. 2009;140:2-11.
- Morales JO, Brayden DJ. Entrega bucal de pequeñas moléculas y biológicos: de polímeros mucoadhesivos, películas y nanopartículas. Current Opinion Pharmacol. 2017;36:22-28.
- Kraisit P, Limmatvapirat S, Nunthanid J, et al. Preparation and characterization of hydroxypropyl methylcellulose/polycarbophil mucoadhesive blend films using a mixture design approach Chem Pharm Bull. 2017;65(3):284-294.
- Giovino C, Ayensu I, Tetteh J, et al. Desarrollo y caracterización de películas de quitosano impregnadas con nanopartículas (NPs) de PEGb-PLA cargadas de insulina: un enfoque potencial para la administración bucal de macromoléculas. Int J Pharm. 2012;428(1-2):143-151.
- Abruzzo A, Bigucci F, Cerchiara T, et al. Mucoadhesive chitosan/gelatin films for buccal delivery of propranolol hydrochloride. Carbohydr Polym. 2012;87(1):581-588.
- Tejada G, Lamas MC, Svetaz L, Salomón CJ, Álvarez VA, et al. Efecto de la técnica de incorporación del fármaco y la combinación de polímeros en el rendimiento de las películas bucales antifúngicas biopoliméricas. Int J Pharmaceut. 2018;548(1):431-442.
- Informe de Transparencia de Mercado (TMR). Oral Thin Films Market – Global Industry Analysis, Size, Share, Growth, Trends, and Forecast, 2018-2026.

Robert Davidson es el CEO de CURE y Chariman of the Board of Directors. Antes de su cargo en CURE Pharmaceutical, fue Presidente y Director General de InnoZen Inc., Director General de Gel Tech LLC, Director General de Bio Delivery Technologies Inc. y ha formado parte de múltiples consejos de administración. El Sr. Davidson fue responsable del desarrollo de varias tecnologías de administración de medicamentos y extensiones de marcas comerciales. Tiene un certificado de máster en gestión de proyectos aplicados por la Universidad de Villanova, un máster en salud pública por la American Military University de Virginia y un máster en salud y bienestar por la Liberty University de Virginia. Davidson también completó sus estudios de postgrado en la Universidad de Cambridge con carta de recomendación.

Jessica Rousset es la Directora de Operaciones de CURE. La Sra. Rousset supervisa las operaciones e impulsa la estrategia corporativa y el crecimiento. Anteriormente, la Sra. Rousset fue Directora de Innovación en el Hospital Infantil de Los Ángeles, donde durante un período de diez años ayudó a lanzar empresas terapéuticas y de dispositivos médicos y fundó y dirigió un acelerador nacional de tecnología pediátrica. Anteriormente, la Sra. Rousset ocupó puestos en el Instituto de Investigación Scripps y en GlaxoSmithkline Biologicals en funciones de laboratorio, investigación clínica y desarrollo empresarial. Se formó como ingeniera bioquímica en el Institut National des Sciences Appliquées de Lyon, Francia.
Deja una respuesta