Resultados
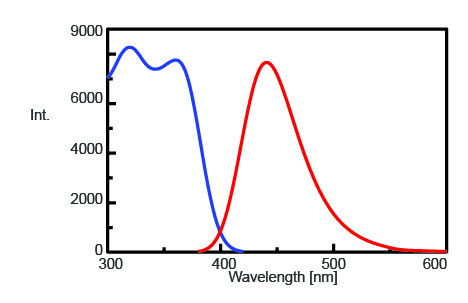
Para encontrar la longitud de onda de emisión máxima para controlar la intensidad de fluorescencia de AMC después de la escisión de la tripsina, se midieron los espectros de excitación y emisión y se muestran en la Figura 1. La longitud de onda de emisión máxima es de 440 nm.
Para estandarizar la intensidad de fluorescencia medida de la solución de enzima a la concentración de AMC aislada, se realizó una titulación y se midió la fluorescencia. Se agregaron alícuotas de 0.5 mL de una solución de AMC de 50 µmol/L a una solución enzimática de 2.5 mL y las concentraciones iniciales y finales de AMC aislada se resumen en la Tabla 1.
Tabla 1. Concentraciones de AMC aislada antes y después de la normalización de la intensidad de fluorescencia.
| Concentración inicial | 3 | 6 | 15 | 30 | 60 | 120 | 240 |
| Concentración final | 0.5 | 1 | 2,5 | 5 | 10 | 20 | 40 |
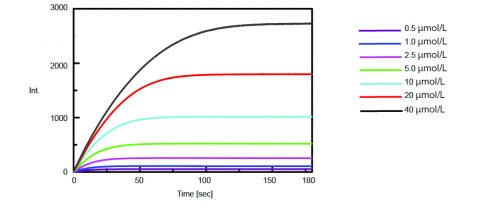
La cinética de la actividad de la tripsina se obtuvo entonces midiendo la intensidad de la fluorescencia de la CMA aislada al escindir la tripsina del sustrato. La figura 2 muestra la medición del curso temporal después de añadir 0,5 mL de concentraciones variables de la solución de sustrato Boc-Gln-Ala-Arg-MCA a 2,5 mL de la solución de enzima.
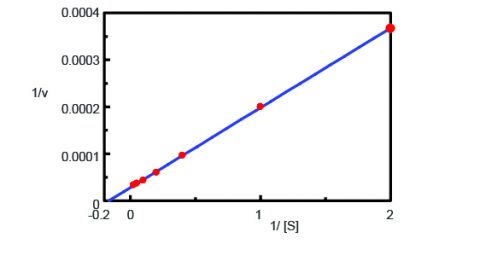
Usando el programa de Análisis Cinético, se trazó un gráfico de Lineweaver-Burk (Figura 3) a partir de las mediciones del curso temporal de la fluorescencia en la Figura 2. El gráfico de Lineweaver-Burk proporciona parámetros cinéticos de la enzima como la velocidad máxima de la reacción, Vmax, y la constante de Michaelis-Menten, Km. Vmax describe la velocidad de la reacción cuando la enzima está saturada de sustrato, mientras que Km indica la cantidad de sustrato para alcanzar la máxima velocidad de reacción. La Vmax fue de 35.270 nmol/L-min-1 y la Km de 5,99. La ecuación de la línea fue 1/v = 0,000270 – 1/ + 0,0000284.
Deja una respuesta