Fuerzas dipolo-dipolo
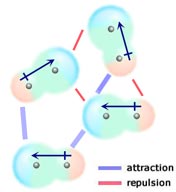
Si dos moléculas neutras, cada una con un momento dipolar permanente, se juntan de forma que sus extremos con carga opuesta se alinean, se atraerán. En un líquido o en un sólido, estas alineaciones se ven favorecidas frente a aquellas en las que los extremos con carga similar de las moléculas están cerca y, por tanto, se repelen.
Una razón por la que el CH3F tiene un punto de ebullición más alto (-84 °C) que el CF4 (-128 °C) es que el CF3H tiene un momento dipolar permanente, mientras que el CF4 no. Para entender bien esto hay que saber que el CF4 tiene forma tetraédrica y el CH3F es aproximadamente tetraédrico (no hay una gran diferencia en las formas de estas moléculas). Los enlaces carbono-flúor de ambas moléculas son polares (el flúor es mucho más electronegativo que el carbono), pero la presencia de cuatro enlaces C-F en la molécula tetraédrica de CF4 hace que la molécula sea globalmente no polar. El momento dipolar del único enlace C-F en el CH3F no es anulado por los dipolos del enlace C-H (que son muy pequeños) por lo que el CH3F tiene un momento dipolar permanente.
Un tipo de fuerza intermolecular que puede surgir en circunstancias particulares y que suele clasificarse como una interacción dipolo-dipolo, aunque tiene cierto carácter de enlace covalente es el enlace de hidrógeno.
Deja una respuesta