- Introducción
- Experimental
- Materiales
- Síntesis de los compuestos de intercalación
- Caracterización
- Resultados y discusión
- Caracterización por DRX
- Espectro FTIR
- Modelo estructural de los compuestos de intercalación de Kaol/alquilamina
- Análisis térmico
- Cinética de Reacción de Descomposición
- Conclusiones
- Contribuciones de los autores
- Declaración de conflicto de intereses
- Agradecimientos
Introducción
El diseño y la fabricación de nanocompuestos de arcilla/polímero han despertado un gran interés tanto en la comunidad científica como en la de ingeniería (Cheng et al., 2017). Se ha desarrollado una amplia variedad de nanocompuestos de arcilla/polímero y se están utilizando en una aplicación generalizada (Gogoi y Raidongia, 2017). La pre-intercalación de arcillas seguida de la incorporación de polímeros en la capa de minerales de arcilla es un enfoque ampliamente adoptado para la preparación de nanocompuestos de arcilla/polímero (Li et al., 2009; Zare et al., 2017). Mientras se intercalan dentro de las capas de arcilla inorgánica, las cadenas de polímeros orgánicos reducen naturalmente su movilidad estructural y algunas de ellas asumen una conformación altamente organizada dentro de la estructura de capas.
En la naturaleza, la caolinita (Kaol) es un tipo de mineral de arcilla con una estructura de capas de silicato de aluminio dioctaédrico 1:1 (Brindley y Robinson, 1945). Las capas del Kaol se mantienen unidas por enlaces de hidrógeno, interacciones dipolo-dipolo y fuerzas de Van der Waals (Brindley et al., 1967). Sin embargo, sólo un número limitado de especies orgánicas altamente polares, como la urea (Makó et al., 2009), el dimetilsulfóxido (Costanzo y Giesse, 1986), la formamida (Frost et al., 2000a), la hidracina (Cruz y Franco, 2000) y el acetato de potasio (Frost et al., 2000b) se intercalaron con éxito en la galería de Kaol. La intercalación de pequeñas moléculas en las capas de Kaol provoca un aumento del espaciado basal, y puede utilizarse como paso previo de expansión para la posterior inserción de especies de gran tamaño y no reactivas mediante el desplazamiento de las pequeñas moléculas preintercaladas (Cheng et al., 2015). Por ejemplo, según los informes anteriores, un compuesto de intercalación Kaol/metanol puede ser un intermedio eficaz para la posterior reacción de intercalación con etilenglicol (Hirsemann et al., 2011), hexilamina (Matusik et al., 2012), n-alquilaminas (Gardolinski y Lagaly, 2005) y sales de amonio cuaternario (Cheng et al., 2016). Además, la mayoría de las moléculas invitadas son difíciles de insertar en el espacio intercalar, una de las razones son los fuertes enlaces de hidrógeno, otra es que no hay iones intercambiables en la estructura de Kaol.
Aunque los nanocompuestos de arcilla / polímero han sido bien desarrollados en los últimos años, para sintetizar nuevos nanocompuestos de arcilla / orgánicos para la aplicación potencial todavía presenta un gran desafío (Kotal y Bhowmick, 2015). Para resolver este problema, es realmente urgente averiguar el proceso de intercalación de la caolinita a escala nanométrica y realizar una investigación exhaustiva del mecanismo de descomposición con tecnología moderna y herramientas analíticas. El análisis térmico y el cálculo cinético de los compuestos de intercalación arcilla-polímero pueden ayudar a caracterizar los procesos de descomposición y proporcionar una base científica para el control de las reacciones de intercalación (Zhang et al., 2015). Los parámetros cinéticos del proceso de reacción de descomposición, como la energía de activación, el preexponencial, los órdenes de reacción y la constante de velocidad se evaluaron con los datos de los termogramas de arcilla/polímero. En este estudio, se investigó la intercalación de Kaol con varias alquilaminas. Además, se investigó sistemáticamente el proceso de intercalación y el mecanismo de descomposición.
Experimental
Materiales
El caolín utilizado en este estudio fue explotado desde Zhangjiakou, China. La composición mineral principal es una caolinita bien ordenada (95% en masa). Se molió para pasar un tamiz de 325 mallas (partículas que miden < 44 μm) antes de la intercalación. La alquilamina hexilamina (HA, 99%), la dodecilamina (DA, químicamente pura) y la octadecilamina (OA, químicamente pura) se adquirieron en la empresa química Nanjing Shuguang, China. El dimetilsulfóxido (DMSO, reactivo analítico), el metanol (MeOH, reactivo analítico) y el tolueno (99%) se obtuvieron de Xilong Chemical Company, China, y se utilizaron tal como se recibieron, sin más purificación. La fórmula química y la fórmula estructural de HA, DA y OA se muestran en la Tabla 1.

Tabla 1. Fórmula química y estructural de HA, DA y OA.
Síntesis de los compuestos de intercalación
Primero, se preparó el compuesto de intercalación Kaol/DMSO dispersando 20,0 g de Kaol en una mezcla de 36,0 g de DMSO y 4,0 g de agua. La mezcla se agitó en un baño de agua durante 2 h a 95°C, y luego la suspensión se separó por centrifugación con etanol. En segundo lugar, el compuesto de intercalación Kaol/DMSO se utilizó como precursor para una reacción posterior con MeOH. Se añadió MeOH al Kaol pre-intercalado y la mezcla de reacción se agitó durante 10 días, sustituyendo cada día el MeOH por la misma cantidad de MeOH fresco. El precipitado de la mezcla se separó por centrifugación y se secó en un horno a 60°C durante 12 h para obtener compuestos de intercalación Kaol/MeOH. Finalmente, se mezclaron 2 g de compuesto de intercalación Kaol/MeOH con 30,0 mL de soluciones de metanol HA, DA u OA (1 mol/L) agitando a temperatura ambiente, respectivamente. Las dispersiones se centrifugaron después de la reacción durante 24 h. Los sedimentos se lavaron tres veces con tolueno para eliminar el exceso de HA, DA u OA. Las muestras se secaron a temperatura ambiente durante 12 h y se molieron en polvo con un mortero de ágata (Komori et al., 1999). Los compuestos resultantes se etiquetan como Kaolpi/HA (pi como pre-intercalado), Kaolpi/DA, y Kaolpi/OA.
Caracterización
Los patrones de DRX se registraron en un difractómetro de rayos X Rigaku D/max 2500PC con radiación Cu Kα (λ = 1,54178 Å) operando a 40 kV y 150 mA. Las muestras de especímenes orientados al azar se escanearon en el rango 2θ entre 1 y 20° a una velocidad de 2° min-1. Se utilizó un espectrofotómetro Thermo Fisher Nicolet 6700 para registrar los espectros FTIR dentro del rango de 4.000~400 cm-1. Los análisis TG-DSC se realizaron con un analizador térmico simultáneo Mettler-Toledo TG-DSC I/1600 HT bajo atmósfera de nitrógeno. Se colocaron veinte miligramos de muestra en un crisol de alúmina y se calentaron de 30 a 1.100°C con una serie de velocidades de calentamiento de 4, 6, 8, 10°C min-1.
Resultados y discusión
Caracterización por DRX
Los patrones de DRX del Kaol prístino y sus compuestos de intercalación se muestran en la Figura 1. El patrón del Kaol prístino muestra una estructura de capas bien ordenada con un espacio basal de 0,71 nm. Este valor coincide con el patrón de referencia estándar 14-0164 de ICDD. Al ser tratado con DMSO, apareció un nuevo pico de reflexión basal a 1,14 nm, lo que indica que el DMSO se insertó con éxito en las intercapas de Kaol. Después de que el compuesto de intercalación Kaol/DMSO fuera tratado con MeOH, la característica de reflexión de 1,14 nm (001) del compuesto de intercalación Kaol/DMSO se desplazó a 0,86 nm. Matusik et al. (2012) informaron de que el compuesto Kaol/DMSO/MeOH se secó a 110°C, la reflexión con d = 1,12 nm desapareció y se observó una reflexión amplia con un máximo a 0,95 nm. Basándose en la fórmula química Al2Si2O5(OH)3.20(OCH3)0.80 del compuesto de intercalación Kaol/DMSO que se ha calculado según la base del análisis CHNS, mostró que alrededor de 1/3 de los grupos OH de la superficie interna fueron reemplazados por grupos metoxi, y esta observación también sugiere la formación de un compuesto de intercalación Kaol/MeOH (Tunney y Detellier, 1996; Cheng et al., 2015). Los patrones de DRX también muestran que los compuestos Kaol/MeOH intercalados con HA, DA y OA expanden la estructura a lo largo del eje c, dando lugar a una gran distancia entre capas de 2,86, 4,08 y 5,66 nm, respectivamente. Las longitudes de las cadenas moleculares de HA, DA y OA son de 1,56, 2,51 y 3,65 nm, respectivamente (McNulty et al., 2011, 2014). En general, la distancia entre capas de los compuestos de intercalación Kaol/alquilamina aumentó con la longitud de la cadena alquílica de las alquilaminas, pero la molécula de alquilamina no es una estructura de una sola capa o bicapa que es perpendicular a la superficie Kaol.
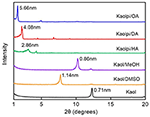
Figura 1. Patrones de DRX de Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA y Kaolpi/OA.
Espectro FTIR
La espectroscopia FTIR ha sido ampliamente utilizada en la caracterización de compuestos de intercalación (Ledoux y White, 1964; Frost et al., 2000c; Cheng et al., 2012). En la figura 2 se muestran los espectros FTIR de los compuestos de intercalación originales Kaol, Kaolpi/HA, Kaolpi/DA y Kaolpi/OA. Las bandas características a 432, 470 y 541 cm-1 (Figura 2B) pertenecen al modo de deformación de Si-O, Si-O-Si y Al-O-Si. Las otras bandas a 1.009, 1.031 y 1.114 cm-1 (Figura 2C) se asignan a las vibraciones de estiramiento de Si-O-Si en la capa de Kaol. Comparando los espectros de Kaol y de sus compuestos intercalados, la posición de las bandas no tiene ninguna variación aparente, lo que indica que estas bandas de vibraciones de estiramiento no se ven afectadas por las moléculas intercaladas.
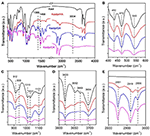
Figura 2. Espectros infrarrojos de Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Las bandas a 912 y 938 cm-1 (Figura 2C) pertenecen a la deformación OH de los grupos hidroxilos internos y de los grupos hidroxilos de la superficie interna. Hay cuatro bandas obvias de estiramiento de hidroxilos a 3.694, 3.669, 3.652 y 3.620 cm-1 (Figura 2D) en el espectro del Kaol original, las bandas a 3.694, 3.669 y 3.652 cm-1 son causadas por los grupos hidroxilos de la superficie interna, mientras que la de 3.620 cm-1 resulta de los grupos hidroxilos internos (Farmer, 1964; Ledoux y White, 1964; Giese y Datta, 1973). Tras la intercalación de las moléculas de alquilamina, algunas bandas se debilitaron debido al cambio de las interacciones con los átomos vecinos. El desplazamiento a 3.697 cm-1 y la disminución de la intensidad de la banda a 3.694 cm-1 indica que numerosos grupos hidroxilos en Kaol participaron y formaron enlaces de hidrógeno con los grupos amina en las moléculas de alquilamina (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
La presencia de moléculas de alquilamina intercaladas se detectó en el espectro FTIR por los nuevos picos, que se muestran en las figuras 2A,E. Para los compuestos de intercalación, algunos picos característicos obvios, como la banda a 1.388 y 1.468 cm-1, pertenecen al modo de flexión C-H de -CH3 y -CH2, respectivamente. Se observó una nueva banda de vibración a 3.334 cm-1 que se debe al modo de estiramiento de la vibración de estiramiento N-H (Griffiths y De Haseth, 2007; Zhang et al., 2018). Se observó la nueva banda de vibración a 2.956 cm-1, que suele asignarse a la banda de estiramiento asimétrico C-H de los grupos metilo terminales (Cheng et al., 2016). Las dos bandas de vibración a 2.919 y 2.851 cm-1 suelen asignarse a las vibraciones de estiramiento simétricas y asimétricas del -(CH2)n- (Venkataraman y Vasudevan, 2001). La intensidad de las bandas aumenta gradualmente, lo que significa que se han insertado más átomos de carbono de alquilamina en las interconexiones de Kaol. Además, la volatilidad de las alquilaminas disminuirá con el aumento de la cadena de carbono, por lo que la estabilidad de los correspondientes compuestos de intercalación de Kaol aumentará gradualmente con una mayor masa molecular de la alquilamina (Wang et al., 2010).
Modelo estructural de los compuestos de intercalación de Kaol/alquilamina
La disposición de las moléculas intercaladas es la base para el análisis experimental de la estructura del compuesto de intercalación de Kaol/alquilamina. Según Lagaly (1981), los modelos estructurales de los compuestos de intercalación montmorillonita-sal de amonio cuaternario pueden dividirse en tres categorías: (a) monocapas: iones de alquilamina de cadena corta; (b) bicapas: iones de amonio cuaternario de cadena larga; (c) tricapas: cadenas de alquilos retorcidas en minerales de arcilla altamente cargados. Beneke y Lagaly (1982) propusieron además diferentes estructuras de las moléculas de alquilaminas intercaladas basadas en la DRX, que se resumen como sigue (a) las cadenas alquídicas en el espacio intercalado están inclinadas hacia el plano cristalino (001); (b) las cadenas alquídicas están dispuestas en bicapas. Brindley y Moll (1965) describieron que las moléculas intercaladas están inclinadas hacia las láminas de silicato en una sola capa, mientras que el ángulo es de unos 65° con respecto al plano del cristal (001). Si las moléculas que interactúan están unidas uniformemente a todas las superficies de silicato por los grupos hidroxilos activos, se sugiere una organización «extremo a extremo» en pares con cierto desplazamiento longitudinal. El ángulo de inclinación está de acuerdo con la posible forma de empaquetamiento estrecho entre las superficies de oxígeno del silicato y los grupos hidroxilo terminales y el grado de empaquetamiento estrecho de las moléculas de la cadena entre sí.
Las moléculas de alquilo son difíciles de intercalar directamente las capas originales de Kaol ya que carece de iones intercambiables en el espacio entre capas de Kaol. Los precursores válidos son esenciales cuando las moléculas de alquilamina se insertan en la capa intermedia de Kaol. Se informó que la cadena de cloruro de alquil trimetil amonio forma una bicapa inclinada en la intercapa de Kaol y el ángulo de inclinación es de ~36° después del cálculo (Kuroda et al., 2011). Yuan et al. (2013) señalaron que la disposición estructural de las moléculas de sal de amonio cuaternario en la bicapa inclinada de Kaol y el ángulo de inclinación es de ~38,4°. Gardolinski y Lagaly (2005) propusieron que las cadenas alquílicas en las intercapas están totalmente estiradas y orientadas perpendicularmente a la superficie de Kaol por bicapa. Por lo tanto, a partir del análisis de la longitud de la cadena de moléculas de HA, DA y OA, se puede llegar a la conclusión de que el espacio basal después de la intercalación no es suficiente para permitir que la cadena alquílica entre por la vía vertical y por la bicapa. Analizando los resultados de la DRX, se observa que las cadenas alquílicas de HA, DA y OA están inclinadas hacia la superficie Kaol en la bicapa y el ángulo de inclinación de las cadenas alquílicas es de aproximadamente 39,9, 39,9 y 41,1°, respectivamente. Además, debido al enlace hidroxilo entre el hidroxilo de la superficie interna del Kaol y los grupos amina de las moléculas de alquilamina, el modelo estructural más posible para los compuestos de intercalación Kaol/alquilamina se muestra en la Figura 3.
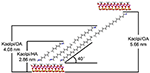
Figura 3. El modelo estructural más posible para los compuestos de intercalación de caolinita/alquilamina.
Análisis térmico
Los resultados del análisis TG-DSC de Kaol y sus compuestos de intercalación se muestran en la figura 4. La principal pérdida de masa de Kaol es la que se produce entre 400 y 600°C, con la máxima tasa de pérdida a 525°C atribuida a la pérdida de agua por la deshidroxilación de la red cristalina, lo que da lugar a la formación de meta-caolinita (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Esta pérdida corresponde a cerca del 12,7% de la masa total, lo que se acerca mucho a la referencia teórica (13,9%). Al comparar las curvas TG-DSC del Kaol original, se observan dos pasos principales de pérdida de masa en el de los compuestos de intercalación Kaolpi/HA, Kaolpi/DA y Kaolpi/OA. La primera se produjo entre 150 y 350°C, lo que se debe a la descomposición de las moléculas de alquilamina intercaladas (Yuan et al., 2013). La segunda ocurrió a unos 500°C se debe a la deshidroxilación del Kaol desintercalado. En el caso de Kaolpi/OA, algunos OA se intercalaron en el espacio de la capa intermedia de silicato para formar una intercalación estable, lo que puede comprobarse por el patrón de DRX. Algunas moléculas se enredan entre sí debido a la larga cadena o a una abrazadera en los nanoscrolls que no puede eliminarse completamente (Li et al., 2015; Liu et al., 2016). A 220°C, la pérdida de masa distintiva se debe a la descomposición del OA recubierto o no unido, mientras que la pérdida de masa a 330°C se atribuye a la descomposición del OA intercalado. El pico exotérmico a 996°C es el resultado de la recristalización de Kaol.
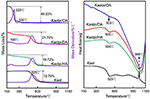
Figura 4. Curvas TG-DSC para Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Al comparar las curvas TG-DSC del Kaol original y de los compuestos de intercalación Kaol/alquilamina (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA), se puede observar: (a) que tiene diferentes pasos de pérdida de masa, así como una diferencia significativa en las pérdidas de masa entre Kaolpi/OA y los otros dos compuestos de intercalación (Kaolpi/HA, Kaolpi/DA). La pérdida de masa para la descomposición de Kaolpi/HA y Kaolpi/DA fue de alrededor del 20%, pero la cantidad de las dos pérdidas de masa para Kaolpi/OA es de alrededor del 50%. Esto podría deberse a que una mayor cantidad de OA se intercaló en el espacio de la capa intermedia de silicato que HA y DA (Wang et al., 2017). (b) La temperatura de deshidroxilación de los compuestos de intercalación fue inferior a la del Kaol original en unos 20°C. Esto se debe a que las moléculas de intercalación ampliaron el espacio entre capas, debilitaron los enlaces de hidrógeno entre las capas de Kaol, provocando una deshidroxilación más fácil de la superficie de Kaol. Por lo tanto, la cristalinidad del Kaol disminuyó bruscamente después de la intercalación, lo que puede confirmarse mediante DRX e IR (por debajo de 800 cm-1). Este resultado es consistente con la conclusión de algunos otros informes de que la temperatura de deshidroxilación fue determinada por la cristalinidad de Kaol (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Cinética de Reacción de Descomposición
La cinética de degradación del compuesto de intercalación Kaol/alquilamina fue investigada por técnicas de termogravimetría. Los parámetros cinéticos (energía de activación E y el factor preexponencial A) del proceso de degradación se calcularon sobre la base de los métodos KAS y Ozawa (Kissinger, 1957; Škvára y Šesták, 1975). El mecanismo de degradación térmica del compuesto de intercalación Kaol/alquilamina se estudió con el método integral de Satava (Xie et al., 2001; Gao et al., 2005; Zhang et al., 2015).
De acuerdo con la teoría de la reacción, la fórmula cinética de descomposición no isotérmica suele expresarse de la siguiente manera:
donde α es la extensión de la tasa de conversión de B(s) en el tiempo t, f (α) es la función del mecanismo de reacción, y k es la constante de velocidad de reacción. k obedece a la siguiente ecuación:
Si la temperatura de la muestra se controla a una velocidad de calentamiento constante (β = dT/dt), la velocidad de reacción puede definirse como sigue:
Después de separar la variable, reordenando con funciones integrales o diferenciales de la Ecuación (4), la Ecuación de KAS (5), y la Ecuación de Ozawa (6) pueden calcularse como sigue:
Donde G(α) representa la función integral de conversión. Debido a la aproximación integral, se utilizaron métodos iterativos para calcular E con el fin de evitar cierta desviación. Las funciones de los métodos iterativos son las siguientes:
Si x = E/RT, la definición de h(x) y H(x) son:
La iteración son como los siguientes tres pasos:
(a) Fijar h(x) = 1 o H(x) = 1, calcular E0 por el método de mínimos cuadrados según la pendiente de la relación lineal lnβ/T2 y lnβ a 1/T.
(c) Sustituya E0 por E1, repita el paso (b) hasta que Ei-Ei-1 < 0. 1 kJ mol-1. Ei es el valor exacto de la energía de activación de la reacción de descomposición.
Los valores E de los compuestos de intercalación Kaol/alquilamina fueron calculados por los métodos KAS, Ozawa e iterativo (Tabla 2). Los resultados calculados por el método KAS fueron más cercanos a los resultados de los métodos iterativos, sin embargo, los resultados del método iterativo de Ozawa mostraron una mayor desviación a los demás. Por lo tanto, la E media de los métodos iterativos puede considerarse como la energía de activación de la reacción de descomposición, ya que suponen una mejora respecto a los métodos KAS y Ozawa. Las E medias de Kaolpi/HA, Kaolpi/DA y Kaolpi/OA son 104,44, 130,80 y 154,59 kJ mol-1. Se puede observar que la media de E entre los compuestos de Kaol/alquilamina tiene una correlación positiva con la longitud de la cadena alquílica. Una de las razones es que la volatilidad se debilita a medida que crece la cadena alquílica. Otra razón es que el Kaolpi/OA posee la mejor estructura de intercalación bien ordenada que es la más difícil de desintercalar. Y estos resultados pueden ser confirmados por los patrones de DRX.
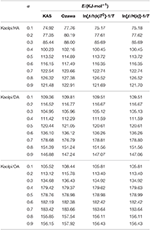
Tabla 2. E de los compuestos de intercalación Kaol/alquilamina con diferentes α calculados por los métodos KAS, Ozawa y de iteración.
Las funciones y A del mecanismo de reacción de descomposición se calculó por los métodos Satava, que se describió como sigue:
Sustituir α en cada función de mecanismo G(α) para obtener el valor de lg, lg de ajuste lineal, y 1/T que corresponde a la velocidad de calentamiento, la función que tiene el mayor ajuste puede ser determinada como la función de mecanismo más probable. Y los valores de E y A pueden obtenerse a través de la pendiente y el intercepto de una curva de ajuste lineal.
Como se muestra en la Tabla 3, se eligen cinco funciones de mecanismo con una bondad de ajuste superior al 90% basándose en la fórmula integral de Satava. Comparando estas cinco funciones, la función de mecanismo No. 9 G(α) = 2 con una bondad de ajuste de alrededor del 97% puede ser considerada como la función de mecanismo más probable, y las curvas de ajuste lineal de la función No. 9 se han mostrado en la Figura 5. E y A también están en el rango normal de la cinética de descomposición. Las funciones del mecanismo de descomposición para los tres compuestos de intercalación Kaol/alquilamina se indican en la Tabla 4.

Tabla 3. Funciones seleccionadas del mecanismo cinético juzgadas por el método integral de Satava.

Figura 5. Curvas de ajuste lineal de la función nº 9 juzgadas por el método integral de Satava.

Tabla 4. Funciones del mecanismo cinético de los compuestos de intercalación Kaol/alquilamina.
Conclusiones
Se han estudiado los posibles modelos de estructura y la cinética de descomposición de los compuestos de intercalación Kaol/alquilamina mediante DRX, FT-IR y TG-DSC. La intercalación del compuesto Kaol/MeOH con HA, DA y OA amplía el espaciado entre capas del Kaol a lo largo del eje c, dando lugar a que la reflexión dominante aparezca a 2,86, 4,08 y 5,66 nm, respectivamente. Además, el espaciado basal después de la intercalación no es suficiente para permitir la entrada de la cadena alquídica por la vía vertical de la monocapa y la bicapa. Se concluyó que las cadenas alquídicas de HA, DA y OA están inclinadas hacia la superficie de Kaol en la bicapa y el ángulo de inclinación de las cadenas alquídicas es de ~40°.
Basado en los métodos KAS, Ozawa e iterativo, se calcularon los resultados de la energía de activación E de los compuestos de intercalación Kaol/alquilamina. La energía de activación media E de Kaolpi/HA, Kaolpi/DA y Kaolpi/OA es de 104,44, 130,80 y 154,59 kJ mol-1. La energía de activación media E entre los compuestos de Kaol/alquilamina tiene una correlación positiva con la longitud de la cadena alquílica. La función de mecanismo optimizada del proceso de descomposición de Kaol/alquilamina se determinó como una difusión 3D con la función integral G(α) = 2. Esta investigación es ventajosa para comprender mejor el mecanismo de descomposición de los nanocompuestos de arcilla/orgánicos, además de proporcionar una inspiración para sintetizar nuevos materiales basados en arcilla.
Contribuciones de los autores
HC y QfL diseñaron el experimento y revisaron el artículo. YZ, QhL y PX realizaron los experimentos y escribieron el artículo. YZ y QhL contribuyeron a partes iguales a este trabajo.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Se agradece al Dr. Luyi Sun (Departamento de Ingeniería Química y Biomolecular y Programa de Polímeros, Instituto de Ciencia de los Materiales, Universidad de Connecticut) la revisión del artículo. Los autores agradecen el apoyo financiero proporcionado por la Fundación Nacional de Ciencias Naturales de China (41602171), la Fundación de Ciencias Naturales de Pekín (8164062) y el Proyecto de Jóvenes Académicos Yue Qi, de la Universidad de Tecnología Minera de China &, Pekín.
Giese, R., y Datta, P. (1973). Hydroxyl orientation in kaolinite, dickite, and nacrite. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., y De Haseth, J. A. (2007). Fourier Transform Infrared Spectrometry. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., y Guggenheim, S. (1985). Dehydroxylation of kaolinite. Am. Mineral. 70, 1-2.
Google Scholar
Deja una respuesta