En la reacción con amoníaco, ¿por qué el agua es el ácido?
Esta es una gran reacción de química general con importantes implicaciones de química orgánica. Otra pregunta similar es, ¿por qué el agua es una base cuando reacciona con un «ácido»? La respuesta a ambas preguntas es: ¡todo es relativo! Aquí en StudyOrgo, recibimos con frecuencia preguntas como esta sobre temas de química orgánica que normalmente se cubren rápidamente, se describen mal o se espera que se conozcan de cursos anteriores. Estos conceptos son realmente importantes para entender los temas más complejos que vienen. Con una membresía a StudyOrgo, obtendrás aún más consejos y trucos sobre temas de química orgánica y mecanismos detallados con explicaciones. El blog de hoy es un avance de los temas y materiales detallados disponibles. Comprueba la membresía de StudyOrgo.com y regístrate hoy!
Recuerda que en términos de ácidos y bases, hay dos definiciones; la de Bronsted y la de Lewis. Los ácidos de Bronsted se definen como donantes de protones, mientras que los ácidos de Lewis se definen como aceptores de electrones. Ambos son ácidos, pero lo que consideramos de forma diferente es si se trata de protones o de electrones. En una solución acuosa, en química general o en bioquímica, pensamos principalmente en la definición de Bronsted porque la disociación de protones de los ácidos cambia la concentración de H+ en la solución, lo que interpretamos como un cambio en el pH y la «acidez» de la solución. Medimos la disociación de los protones de los ácidos, o la aceptación de protones por parte de las bases, con un valor numérico que es el pKa. Cuanto mayor sea el pKa, más débil será el ácido y más fuerte la base. Cuanto menor sea el pKa, más fuerte será el ácido y más débil la base. Un truco fácil para pensar en el pKa es, colocar la versión protonada de la molécula a la izquierda y pensar en ella como un donante de protones. El pKa te dice lo fácil que será esta donación, cuanto más bajo sea el número más fácil será la donación de protones.
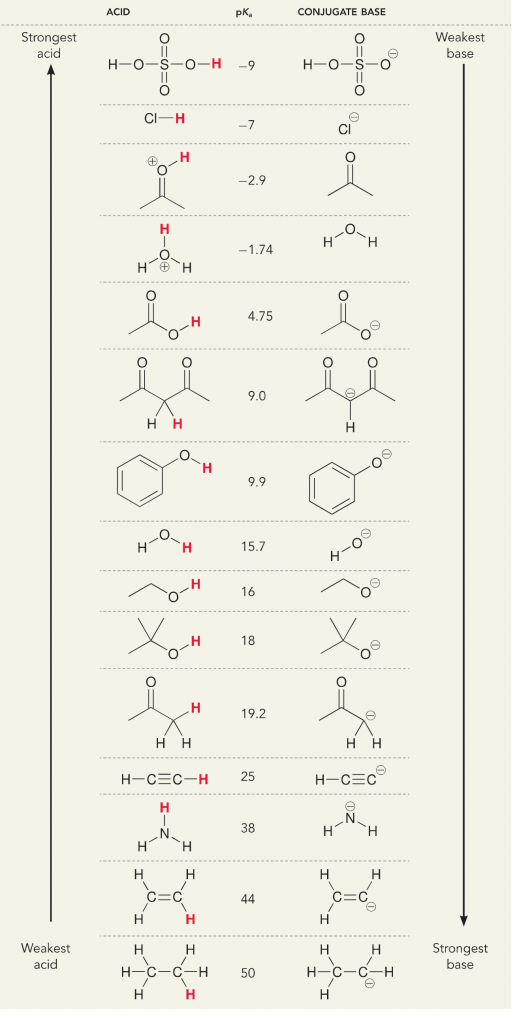
Veamos la reacción del amoníaco y el agua; el pKa para el agua se define como 14. El pKa del amoníaco es ~37.
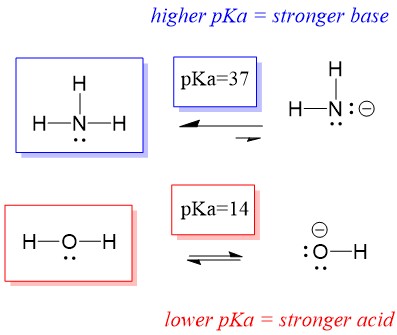
Por lo tanto, como el pKa del agua es menor que el del amoníaco, es un ácido más fuerte que el amoníaco y donará protones a la base del amoníaco. Esta reacción lleva al agua a convertirse en la base conjugada OH- y al amoníaco a convertirse en el ácido conjugado NH4+. Curiosamente, esta es la razón por la que el amoníaco es un agente cáustico, produce hidróxido que reacciona con las manchas y los microorganismos para limpiar y desinfectar eficazmente los artículos del hogar.
Esto es importante como concepto de química orgánica porque la fuerza de los ácidos y las bases en términos de electrones, o la definición de Lewis, es exactamente cómo pensamos en los mecanismos de ruptura y formación de enlaces; el flujo de electrones. La fuerza de los ácidos de Lewis y del ácido conjugado puede ayudar a identificar en qué dirección procederá una reacción. Podemos ver que la reacción del agua un amoníaco es desfavorable, pero en la realidad ocurre suficiente reacción para reducir significativamente el pH del agua (pH~11 con amoníaco).
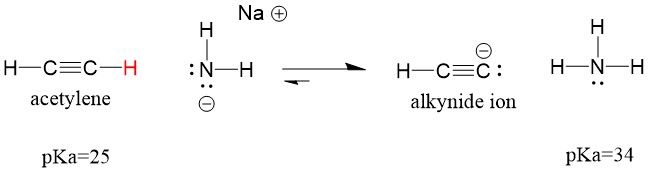
Veamos un acetileno reaccionando con una base para generar un ion alquino, un nucleófilo útil para la formación de enlaces C-C. Si intentamos hacer reaccionar el hidróxido de sodio con el alquino, el ion alquino NO se formará. Esto se debe a que el producto ácido conjugado de la reacción es el agua, que tiene un pKa de 15, es más fuerte que el ácido acetileno original (pKa = 25). Las reacciones SIEMPRE favorecen la formación del ácido más débil, o en este caso, del lado del reactante.
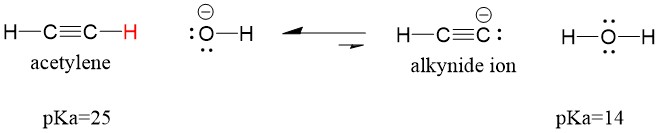
Si cambiamos nuestra base por amida de sodio, que es una base mucho más fuerte, se formará el ion alquino. Esto se debe a que el producto ácido conjugado de la reacción es el amoníaco, que tiene un pKa de 38, y es un ácido conjugado MÁS DÉBIL que el ácido acetileno original (pKa = 25). En este caso, la reacción favorece el lado del producto!

Deja una respuesta