Palabras clave
CADASIL – ictus – RM
Introducción
La Arteriopatía Cerebral Autosómica Dominante con Infartos Subcorticales y Leucoencefalopatía (CADASIL) es una enfermedad hereditaria de pequeñas arterias causada por diferentes mutaciones patogénicas del gen NOTCH-3. Se caracteriza por la asociación de migraña con aura, síntomas psiquiátricos, eventos isquémicos recurrentes a una edad temprana y deterioro cognitivo. Esto y sus típicos hallazgos radiológicos es lo que normalmente nos ayuda a sospechar la enfermedad. Suele considerarse una enfermedad de adultos jóvenes y de mediana edad, pero los casos en ancianos pueden estar infradiagnosticados. Reportamos el caso de un hombre que fue diagnosticado de CADASIL a finales de los setenta gracias al diagnóstico previo de su hija.
Informes de casos
Caso 1
La hija de nuestro paciente tenía 50 años cuando fue enviada a nuestro hospital desde la consulta externa de neurología para un estudio más exhaustivo, debido a los hallazgos radiológicos en su resonancia magnética del cerebro, que consistían en cambios de la sustancia blanca en ambas cápsulas externas, áreas periventriculares bilaterales y lóbulo temporal izquierdo.
Acudía a la citada consulta porque padecía migraña con aura visual desde hacía 30 años, con algunos episodios que sugerían aura visual sin cefalea. No tenía otros síntomas. Era alérgica a la fosfomicina y se había sometido a una amigdalectomía cuando era niña. No tenía otros antecedentes médicos. Sus antecedentes familiares eran notables: su madre tenía migraña y demencia leve y su padre había sufrido un accidente cerebrovascular a la edad de 75 años; su abuelo paterno, su tío y su tía habían sufrido accidentes cerebrovasculares, y el tío había sido diagnosticado de enfermedad de Alzheimer, un primo paterno había recibido en otro lugar el diagnóstico de «vasculitis ANA+» y otro primo paterno había sido diagnosticado de esclerosis múltiple. Tenía dos hijos sanos. La exploración física, incluida una meticulosa exploración neurológica, era completamente normal. La resonancia magnética cerebral repetida mostraba múltiples lesiones hiperintensas en la sustancia blanca de la protuberancia posterior, áreas periventriculares y subcorticales, incluidos los lóbulos temporales anteriores, especialmente el izquierdo, ambos centros semiovales, cápsulas internas y externas, sin signos de microhemorragias recientes o pasadas (figura 1). Todas las demás pruebas, como el hemograma, la glucemia, la función hepática y renal, la velocidad de sedimentación globular, las hormonas tiroideas séricas, el cribado de hipercoagulabilidad, el cribado de vasculitis, el electrocardiograma, la radiografía de tórax, las serologías de sífilis y VIH, y la ecografía de troncos supraaórticos con Doppler, fueron normales, salvo una colesterolemia de 220 mg/dl con colesterol LDL de 152 mg/dl. La biopsia de piel también fue normal. Se encontró una mutación Arg169Cys (sustitución de citosina por timina en el codón 505) en el cuarto exón del gen NOTCH 3, que se sabe que es patogénico, por lo que se le diagnosticó CADASIL. Con este diagnóstico, ambos padres fueron evaluados en nuestra clínica.
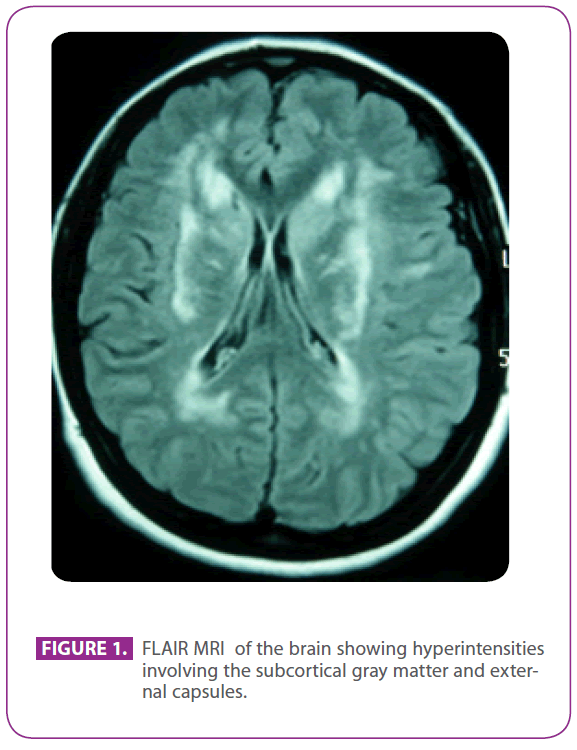
Figura 1: RMN FLAIR del cerebro que muestra hiperintensidades que afectan a la materia gris subcortical y a las cápsulas externas.
Caso 2
Su madre tenía 78 años. Tenía una larga historia de migraña sin aura y, en los dos últimos años, había desarrollado una demencia leve con parkinsonismo simétrico, fluctuaciones y trastorno del comportamiento del sueño REM, sugestivo de demencia con cuerpos de Lewy. La resonancia magnética cerebral descartó enfermedad relevante de la sustancia blanca.
Su padre era un hombre de 79 años con varios factores de riesgo vascular: diabetes mellitus tipo 2, dislipidemia y un tabaquismo de 50 años, con un índice acumulado de 15 paquetes-año, aunque lo había dejado hace 3 años. Tenía una cardiopatía isquémica con un infarto de miocardio posteroinferior en 1991. En los últimos 8 años había tenido tres accidentes isquémicos transitorios y un ictus lacunar correspondientes a diferentes territorios arteriales, con afectación progresiva de la marcha, y en los últimos 6 meses se había vuelto algo retraído y apático. No tenía antecedentes de migraña. Tomaba metformina, clopidogrel, atenolol y atorvastatina. En la exploración física estaba consciente y orientado pero un poco desatento, el lenguaje y la memoria remota y reciente eran normales, mostraba apraxia ideomotora, alteración de la interpretación de similitudes y refranes, sin reflejos de liberación frontal. También mostraba hiperreflexia global con reflejos flexores plantares bilaterales, y una marcha con pasos cortos y movimientos de brazos reducidos. Una tomografía computarizada realizada dos años antes, tras uno de sus ataques isquémicos transitorios, mostraba una extensa enfermedad de la sustancia blanca, especialmente prominente en la cápsula externa y los lóbulos temporales (figura 2).
En resumen, el paciente tenía accidentes cerebrovasculares isquémicos recurrentes, deterioro cognitivo subcortical leve y leucoencefalopatía, altamente sospechosa de CADASIL teniendo en cuenta el diagnóstico de su hija. Se realizó una prueba genética, que mostró la misma mutación NOTCH 3 que su hija y confirmó el diagnóstico.
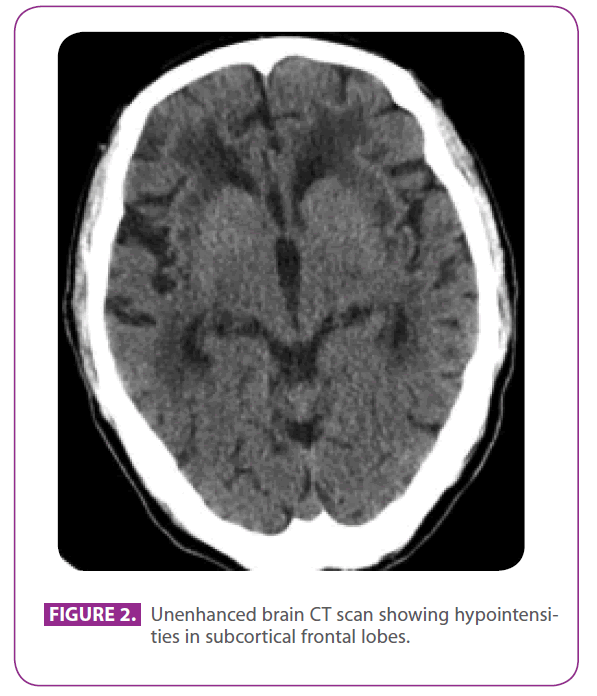
Figura 2: TAC cerebral sin realzar que muestra hipointensidades en los lóbulos frontales subcorticales.
Discusión
CADASIL es la enfermedad hereditaria de pequeños vasos más común. Sin embargo, también puede ser esporádica, ya que se han descrito mutaciones de novo. Está causada por diferentes mutaciones patogénicas en el gen NOTCH-3, que está situado en el cromosoma 19, locus 19p13.2-p13.1, y consta de 33 exones que codifican una proteína de 2321 aminoácidos (1). Esta proteína es un receptor de superficie celular transmembrana de paso único que se expresa en las células musculares lisas arteriales sistémicas, con un dominio regulador extracelular y un dominio transductor intracelular. Hasta la fecha se han descrito más de 190 mutaciones que pueden dar lugar a CADASIL, y todas ellas se producen en los exones 2 a 24 del gen NOTCH 3, que codifican las 34 repeticiones similares al factor de crecimiento epidérmico de la porción extracelular de NOTCH 3. Por tanto, el cribado de estos 23 exones tiene una sensibilidad del 100% y casi la misma especificidad (2). De estas mutaciones, más de 180 son mutaciones de sentido erróneo, al menos 6 deleciones, una inserción, un desplazamiento de marco y 2 duplicaciones. La mayoría de las mutaciones patogénicas de NOTCH3 se producen en los exones 3 y 4 (3).
Todas las mutaciones dan lugar a una adición o pérdida de un residuo de cisteína en una repetición similar a la del EGF, y por tanto a un número impar de residuos de cisteína que produce la formación de puentes disulfuro anormales. El NOTCH3 mutante provoca la degeneración de las células lisas vasculares en las pequeñas arterias y arteriolas y la acumulación de la proteína anormal en la pared de estos vasos, lo que conduce a la estenosis de la luz (1). En el cerebro afecta a las arterias cerebrales y leptomeníngeas penetrantes, provocando la incapacidad de autorregulación de estos vasos y la hipoperfusión de los territorios por ellos irrigados, y por tanto infartos en la sustancia blanca.
El primer síntoma de CADASIL, cuando se presenta, suele ser la migraña con aura, con una edad media de inicio de 30 años. Aparece en el 20 al 40% de los pacientes (4). La mayoría de los ataques son típicos con aura visual o sensorial, pero la mitad de los pacientes tienen también ataques atípicos con aura basilar, hemipléjica o prolongada.
Los eventos isquémicos subcorticales, ataques transitorios o accidentes cerebrovasculares, aparecen en el 60 al 85% de los pacientes, el primero a una edad media de 50 años, aunque puede ocurrir ya en la segunda década. La mayoría de las veces no hay factores de riesgo vascular convencionales o son poco importantes. En dos tercios de los pacientes los eventos isquémicos se presentan clínica y radiológicamente como síndromes lacunares. La mayoría de los pacientes sufren varios accidentes cerebrovasculares, normalmente de 2 a 5, que a lo largo de varios años conducen a dificultades de la marcha, incontinencia urinaria y fecal, demencia y parálisis pseudobulbar (1). El deterioro cognitivo es la segunda manifestación clínica más frecuente. El signo más temprano suele ser el deterioro de las capacidades ejecutivas y de la velocidad de procesamiento, que está presente en la mayoría de los pacientes mayores de 35 años, pero que puede aparecer ya en la primera década de vida (5). Este deterioro cognitivo es progresivo y normalmente empeora con los accidentes cerebrovasculares recurrentes, a los que se añade el deterioro de las actividades instrumentales, la memoria, el lenguaje, el razonamiento y las capacidades visoespaciales. Más del 70% de los pacientes sufren demencia en la sexta década de vida. La afasia grave, la apraxia o la agnosia son raras en CADASIL.
Los trastornos psiquiátricos, principalmente las alteraciones del estado de ánimo, aparecen en el 20% de los pacientes, en general como episodios depresivos graves. La apatía está presente en el 40% de los pacientes y no se relaciona con la depresión Otras manifestaciones clínicas menos comunes son la encefalopatía aguda reversible (6) (en el 10% de los pacientes), la mayoría de las cuales se producen después de una migraña con aura, convulsiones (en el 5 al 10% de los pacientes), sordera, parkinsonismo, hemorragias cerebrales (sobre todo en pacientes con hipertensión arterial) e infarto de miocardio.
A pesar de su completa penetrancia, CADASIL tiene una importante variabilidad de expresión clínica inter e intrafamiliar. La misma mutación NOTCH-3 tiene un amplio espectro clínico, sin diferencias claras entre los pacientes homocigotos y heterocigotos. De hecho, no existe una correlación entre el genotipo y el fenotipo clínico (4). Se desconoce la razón de estas diferencias, pero se han descrito algunos posibles modificadores del fenotipo de CADASIL, como el tabaquismo actual para el riesgo de ictus y la edad del primer ictus, la hipertensión arterial para el riesgo de ictus, o los niveles de homocisteína para la edad de inicio de la migraña (3,4). Estos y otros factores podrían influir en la expresión clínica de la enfermedad modificando la expresión génica o afectando a otras vías fisiopatológicas que pueden conducir a las mismas manifestaciones clínicas.
Los cambios radiológicos aparecen en todos los individuos con una mutación de CADASIL antes de los 35 años y aumentan con el tiempo. Las características más tempranas y frecuentes son áreas puntiformes hiperintensas sin realce en la sustancia blanca cerebral y en las estructuras subcorticales en imágenes ponderadas en T2 y de recuperación de inversión atenuada por fluidos de la RM. La afectación de las cápsulas externas y de la parte anterior de los lóbulos temporales es típica de esta enfermedad y una pista para el diagnóstico, ya que ayudan en el diagnóstico diferencial con otras afecciones como la enfermedad de los vasos pequeños (1).
CADASIL se considera comúnmente una enfermedad de adultos jóvenes y de mediana edad, pero el número de pacientes ancianos podría estar infradiagnosticado (7,8). Nuestro segundo caso puede servir de ejemplo: un paciente de 79 años con factores de riesgo vascular y accidentes cerebrovasculares recurrentes, con enfermedad de la sustancia blanca que fue considerada secundaria a la enfermedad de pequeños vasos por varios neurólogos. Sólo se llegó al diagnóstico tras conocer la mutación de su hija. En los casos sin antecedentes familiares claros, una mente abierta y una cuidadosa atención a los hallazgos radiológicos sugestivos, como la afectación de la cápsula externa o de los lóbulos temporales anteriores, pueden ser la única pista para un diagnóstico correcto.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vázquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: una serie de casos de 11 pacientes. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. Espectro clínico de CADASIL y el efecto de los factores de riesgo cardiovascular en el fenotipo: estudio en 200 individuos reclutados consecutivamente. Stroke 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. The influence of genetic and cardiovascular risk factors on the CADASIL phenotype. Brain. 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepezil in patients with subcortical vascular cognitive impairment: a randomised double-blind trial in CADASIL. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. «CADASIL coma»: una encefalopatía aguda infradiagnosticada. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. Homocigosidad para una mutación NOTCH3 en un paciente de 65 años con CADASIL con síntomas leves: un informe familiar. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. La expresividad notablemente variable de CADASIL: informe de un hombre mínimamente sintomático a una edad avanzada. J Neurol. 2009;256:1026-7
Deja una respuesta