PAPELES ORIGINALES
Detección de antígeno de superficie de la hepatitis B utilizando sueros agrupados. Un análisis coste-beneficio
E. Fernández, L. Rodrigo1, S. García, S. Riestra1 y C. Blanco
Servicio de Bioquímica. Hospital de Cabueñes. Gijón. 1Servicio de Gastroenterología. Hospital Central de Asturias. Oviedo. España
Correspondencia
ABSTRACT
Objetivos: examinar la viabilidad y realizar un análisis coste-beneficio de una estrategia de pooling de 5 muestras mediante un enzimoinmunoanálisis (EIA) para el cribado del antígeno de superficie de la hepatitis B (HBsAg).
Material y métodos: para evaluar la sensibilidad y la especificidad del método de pooling, cada uno de los 40 sueros positivos (de débil a intensamente positivo al HBsAg) y 250 sueros negativos se analizaron en un pool con 4 sueros negativos al HBsAg. El límite de detección para HBsAg/ad y HBsAg/ay se evaluó utilizando sueros de un panel de subtipos purificados. Se realizó un estudio en condiciones reales utilizando pools de 340 mujeres embarazadas.
Resultados: la sensibilidad y la especificidad de esta técnica fueron del 100%. El coeficiente de correlación entre las relaciones muestra/subtipo de 40 muestras estudiadas en condiciones individuales y en pool fue de 0,792 (p < 0,005). El método pooling tiene niveles de detección más bajos para HBsAg/ad y HBsAg/ay con 0,20 ng/mL y 0,12 ng/mL, y el método simple con 0,34 ng/mL y 0,29 ng/mL, respectivamente. El método pooling no pierde sensibilidad para valores de hasta 100 UI/L de anti-HBs en los cuatro sueros mezclados con un suero positivo. El análisis coste-beneficio demostró que el método de pooling podía ahorrar desde un 30% hasta un 75% del coste de la determinación del HBsAg, según que las seroprevalencias fueran del 10% o del 1%, respectivamente.
Conclusiones: la prueba EIA de HBsAg agrupada no fue peor que la prueba EIA única, y fue una estrategia rentable y válida en áreas con una prevalencia alta, media o baja.
Palabras clave: Antígeno de superficie de la hepatitis B. Agrupación de sueros. Análisis coste-beneficio.
Rodrigo L, Fernández E, García S, Riestra S, Blanco C. Detección del antígeno de superficie de la hepatitis B mediante pool de sueros. Un análisis coste-beneficio. Rev Esp Enferm Dig 2006; 98: 112-121.
Introducción
La infección por el virus de la hepatitis B (VHB) es una enfermedad que afecta a millones de personas en todo el mundo. Su principal reservorio es el de los portadores crónicos del VHB. Se estima que unos 300 millones de personas en todo el mundo están infectadas por este virus (1). Las consecuencias médicas de la infección por el VHB son variables e imprevisibles, dependiendo de factores como la edad del paciente y su estado inmunitario. El VHB es un agente etiológico bien reconocido de la hepatitis crónica, la cirrosis hepática y el carcinoma hepatocelular.
Sin embargo, existen grandes diferencias en la prevalencia de la infección, lo que ha llevado a establecer tres grandes áreas de endemicidad alta, media y baja (2). En la mayoría de los países desarrollados, la prevalencia de portadores crónicos del VHB es inferior al 2%, y la transmisión de la infección se produce, sobre todo, en adultos pertenecientes a determinados grupos de riesgo (consumidores de drogas, hombres homosexuales, heterosexuales promiscuos, trabajadores sanitarios) (3). En España se ha encontrado una prevalencia del 1,2% de portadores del VHB (4), siendo obligatoria la identificación del HBsAg en donantes de sangre, mujeres embarazadas y sujetos sometidos a programas de autotransfusión.
La técnica de pooling de suero intenta reducir costes sin perder eficacia, y se ha utilizado principalmente en países en vías de desarrollo en la búsqueda de anticuerpos contra el virus de la inmunodeficiencia humana (VIH) (5-14), y el virus de la hepatitis C (VHC) (15-19). Los resultados obtenidos con este método han demostrado ser muy prometedores, ya que han disminuido significativamente el coste de las pruebas de laboratorio sin que disminuya significativamente su sensibilidad.
El presente estudio trata de evaluar si la técnica de pooling de suero es aplicable en la detección del HBsAg para dilucidar los factores que pueden modificar su sensibilidad, y realizar un análisis coste-beneficio de esta técnica diagnóstica.
Material y métodos
Determinación del HBsAg
Para la evaluación del HBsAg se utilizó el ensayo Imx HBsAg (Abbott Laboratories, Abbott Park, IL), que es un Enzimoinmunoensayo (EIA) cualitativo de tercera generación de micropartículas. La presencia o ausencia de HBsAg se determina comparando la tasa de formación del producto fluorescente con un punto de corte, que se calcula a partir de la tasa del calibrador negativo (N) (plasma humano no reactivo para HBsAg). El ensayo Imx HBsAg calcula una relación entre la tasa de la muestra (S) y la tasa del calibrador negativo. El valor de corte (S/N) se estableció como 2 para la EIA de suero único.
La técnica de pooling se realiza añadiendo 200 mcL al pool, es decir, obteniendo una mezcla de 40 mcL de cada uno de los 5 sueros que componen el pool (dilución 1/5). El punto de corte se estableció como la media de las muestras negativas más 3 desviaciones estándar, dando así un valor de 1. Se considera, por tanto, que existe una muestra no reactiva en este grupo de 5 cuando el coeficiente S/N es < valor de corte, mientras que un pool S/N > de corte puede indicar la presencia de al menos una muestra reactiva. En este caso, es necesario volver a analizar las muestras individuales para identificar la(s) muestra(s) reactiva(s). Todas las pruebas se realizan por duplicado.
De acuerdo con lo anterior, la especificidad se evaluó mediante la valoración del HBsAg en 50 pools de 250 sueros negativos. Para calcular la sensibilidad, se analizaron 40 sueros con la misma distribución de concentración que la población general de la que se tomaron muestras en un pool con 4 sueros negativos.
Subtipos de HBsAg (ad y ay)
El límite de detección de Imx HBsAg para ad y ay se evaluó utilizando sueros de un panel de subtipos de HBsAg purificados (panel de sensibilidad al HBsAg de la hepatitis, Abbott Laboratories). Las concentraciones de HBsAg/ad y HBsAg/ay oscilaron entre 0,13 y 2,32 ng/mL y entre 0,21 y 2,24 ng/mL, respectivamente. El límite de detección se determinó en solitario y en un pool con 4 sueros HBsAg negativos.
Influencia del nivel de anti-HBs
Para comprobar si la existencia de anticuerpos anti-HBs en los sueros estudiados mediante la prueba de pool podría neutralizar el HBsAg e interferir en la sensibilidad de la técnica se aplicó el método de pool de un suero con una concentración conocida de HBsAg/ad y HBsAg/ay con cuatro sueros con títulos conocidos de anti-HBs.
La determinación cuantitativa de anti-HBs se llevó a cabo con un método de inmunoensayo enzimático de micropartículas (mEIA) utilizando un autoanalizador AxSYm (AxSYmTM AUSAB, Abbott Laboratories, Abbott Park, IL). Los sueros con títulos elevados de anti-HBs se obtuvieron de controles posvacunados contra el VHB y de pacientes que se habían recuperado de la hepatitis B.
Test de pool en el cribado del HBsAg
Para evaluar la validez del test de pool, se llevó a cabo una simulación de operaciones de campo utilizando el método anterior en 1.525 muestras de suero obtenidas de mujeres embarazadas en un estudio anterior realizado por nosotros para estimar la prevalencia de la infección por el VHC, y cuyas muestras se almacenaron a -20 ºC desde su recogida. De entre ellas, seleccionamos aleatoriamente 300 muestras de HBsAg negativo y 14 de HBsAg positivo. Las determinaciones se realizaron sin conocimiento previo de las composiciones de los pools.
Reducción del número de pruebas
Cuando un pool resulta positivo, es necesario volver a analizar individualmente cada componente para identificar la muestra o muestras que son HBsAg-positivas. Por lo tanto, cuanto mayor sea el número de pools positivos (es decir, la prevalencia del HBsAg), menor será la reducción del número de pruebas realizadas.
Sobre esta base, se calculó el porcentaje de reducción del número de pruebas cuando se utilizaron sueros agrupados para el cribado del HBsAg, en las condiciones más desfavorables e improbables (baja prevalencia), es decir, cuando no había más de un suero positivo en ninguno de los pools. Por ejemplo, para una seroprevalencia de HBsAg del 2%, si se analizan 100 sueros en 20 pools, 2 de ellos serán positivos. Por lo tanto, es necesario añadir 10 determinaciones (10 sueros reanalizados individualmente) a las 20 iniciales (20 pools), lo que da lugar a 30 determinaciones en total. En este ejemplo, se podría ahorrar el 70% del coste. Para llevar a cabo un análisis coste-beneficio, se estimó que el precio de las pruebas de HBsAg era de 3 dólares estadounidenses por cada muestra. Esto se basó en el precio medio real del kit comercial en nuestro hospital.
Análisis estadístico
Los datos se recogieron en una base de datos y posteriormente se analizaron utilizando el paquete estadístico SPSS para Windows, versión 10.0. Se empleó la correlación lineal no paramétrica de Spearman. Los resultados se expresan como media ± DE. Un nivel de p < 0,05 se consideró estadísticamente significativo.
Resultados
Ninguno de los 50 pools de sueros HBsAg-negativos resultó positivo (pool S/N > 1), y se obtuvieron los siguientes valores de pool S/N 0,767 ± 0,076 (rango 0,67-0,88). Con esta muestra, la especificidad de esta técnica de pool fue, por tanto, del 100%. Por otra parte, los 40 sueros positivos al HBsAg, cuando se determinaron en forma de pool, arrojaron valores de S/N superiores a 1 (siendo la sensibilidad también del 100%). El coeficiente de correlación entre las relaciones S/N de estas 40 muestras estudiadas en forma individual y en pool fue de 0,792 (p < 0,05).
El 26,6% de los pools con muestras que presentaban títulos elevados de HBsAg tenían una relación S/N incluso mayor que la muestra individual. Sin embargo, el coeficiente de correlación de las muestras con títulos bajos de HBsAg (S/N única < 25, n = 12) fue excelente (R = 0,9739, p < 0,05), como puede verse (Fig. 1).

El límite de detección utilizando el método único fue de 034 ng/mL para el subtipo ad y 0,29 ng/mL para el subtipo ay, mientras que para el método pooling se detectaron niveles más bajos de antígeno: 0,20 ng/mL y 0,12 ng/mL, respectivamente. Se muestran los resultados de la aplicación de las técnicas individuales y de pool a sueros con diferentes concentraciones de HBsAg/ad y HBsAg/ay (Fig. 2).

Cuando el título de anti-HBs en el pool es inferior a 100 UI/L, la técnica no pierde sensibilidad; incluso cuando los títulos de anti-HBs alcanzan las 10.000 UI/L, la técnica sigue siendo capaz de detectar concentraciones de HBsAg tan bajas como 1,5 ng/mL. Se presenta la influencia de las diferentes concentraciones de anti-HBs en el límite de detección de los subtipos de HBsAg cuando se utiliza el método de pooling (media de 2 determinaciones) (Fig. 3).
En la investigación realizada en condiciones reales en los sueros de mujeres embarazadas, el método de pooling dio como resultado la clasificación correcta de todas las muestras analizadas. En consecuencia, la sensibilidad y la especificidad fueron del 100%.
Hay una disminución del porcentaje de reducción del número de pruebas que se consigue con el método de pooling a medida que aumenta la seroprevalencia del HBsAg. Se observa que incluso con prevalencias de HBsAg tan elevadas como el 10% en la muestra estudiada, se alcanza un ahorro mínimo de al menos el 30% (Fig. 4).

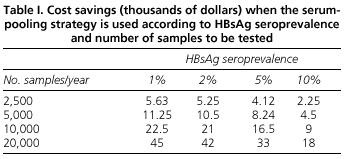
El análisis de los beneficios económicos de la estrategia de pooling de suero muestra que el ahorro conseguido depende tanto de la prevalencia de HBsAg como del número de determinaciones a realizar. Así, para países con una baja prevalencia como el nuestro, el método de pooling reduce el coste de las pruebas de HBsAg. Por ejemplo, hemos estimado que en 2.500 determinaciones realizadas en un laboratorio durante un año utilizando el método de pooling, el ahorro será de 5.630 dólares estadounidenses, y en el caso de un hospital muy ocupado que realice 20.000 determinaciones anuales, el ahorro alcanzará los 45.000 dólares estadounidenses (Tabla I).
Discusión
Una aproximación al método de pooling es mantener la dilución y el volumen final de la mezcla de reacción en cada prueba pooled para no perder sensibilidad, para lo cual se reduce el diluyente y se sustituye parcialmente por los sueros adicionales. De este modo, no es necesario modificar el valor de corte con respecto al método estándar en las muestras individualizadas. Sin embargo, el método utilizado en nuestro estudio fue automatizado y la dilución de las muestras se realizó mediante un autoanalizador. Por esta razón, cada muestra presenta una dilución de 1 en 5 al ser mezclada con los otros 4 sueros. Por lo tanto, en nuestro estudio fue necesario modificar el valor de corte y limitar el número de sueros en el pool para no perder la sensibilidad.
En cuanto a la especificidad, es necesario destacar que el valor medio de los pools fue sólo un poco más de 3 desviaciones estándar del corte. Por lo tanto, cabría esperar un falso positivo en aproximadamente el 1% de las ocasiones. Creemos que esto es aceptable, ya que la especificidad es casi del 100% (99,9%). Se necesitará un estudio con un mayor número de muestras negativas de un gran número de individuos diferentes para establecer la verdadera especificidad de este ensayo.
Aunque la correlación entre las pruebas de muestras individuales y de conjunto es buena, la línea de regresión intercepta el eje X en una relación S/N de 3 (el valor Y correspondiente es 1). Esto puede significar que cualquier muestra con una relación S/N entre 2 y 3 en la prueba de una sola muestra tendría un valor inferior a 1 y, por tanto, no se detectaría en la prueba agrupada.
Para una prevalencia del 1% de sueros positivos al HBsAg, un modelo matemático descrito por Liu et al. (19) logró la máxima reducción (80,5%) del número de pruebas para un tamaño de pool de 11 sueros. Sin embargo, en nuestra opinión, podría surgir un problema con la especificidad debido al efecto de la agrupación en la tasa de falsos positivos. Un aumento de las proteínas no específicas, como resultado de la mezcla de sueros, puede dar lugar a un aumento del color de fondo. Con el tamaño de pool de 5 elegido para nuestro estudio, y el cambio del valor de corte de 2 a 1, no se observaron pérdidas en la sensibilidad (falsos negativos) ni en la especificidad (falsos positivos).
Los resultados del presente estudio muestran que la técnica de pool de sueros para la detección del HBsAg es altamente sensible y específica, y además permite un considerable ahorro económico. Estos resultados son similares a los obtenidos por otros investigadores que aplicaron el método de pooling al estudio de la infección por VHC y VIH (5-19). Hasta el momento, sólo se han comunicado dos estudios (20,21) sobre la aplicación del método de pooling al estudio de la infección por el VHB. En uno de ellos (20), realizado al llevar a cabo el cribado prenatal rutinario de la hepatitis B mediante el análisis de 10 pools de muestras, los autores encontraron una baja prevalencia de portadores crónicos (0,43%), y concluyen que se trata de un método coste-efectivo y una estrategia válida en áreas de baja seroprevalencia, con una reducción de la sensibilidad estimada en el 4,2%. La aplicación en nuestro estudio del método de pooling a mujeres embarazadas, entre las que la prevalencia de portadores crónicos de HBsAg es del 0,93%, demostró una sensibilidad y especificidad del 100%.
La distribución de los dos subtipos principales de HBsAg (ad y ay) en nuestro medio es aproximadamente del 50% para cada uno, siendo el ay más frecuente en los drogadictos que utilizan la vía parenteral (22). Hemos demostrado que el método de pooling mejora la sensibilidad, es decir, disminuye el límite de detección de un inmunoensayo utilizado para la determinación de los dos subtipos principales de HBsAg. Nuestra técnica de pooling permite detectar cantidades tan pequeñas como 0,20 ng/mL de HBsAg/ad, y 0,12 ng/mL de HBsAg/ay, incluso inferiores a las obtenidas con el método estándar. El hallazgo de una mayor sensibilidad con las pruebas de pool no es sorprendente, ya que esto ha sido reportado por otros autores (16). Es importante evaluar la sensibilidad del kit EIA utilizado para la prueba de pool, ya que no todos los kits pueden ser adecuados para el cribado de pools, como se ha demostrado en el caso de los anticuerpos contra el virus de la hepatitis C (23,24).
La presencia de anti-HB en los sueros del pool podría modificar la sensibilidad de la técnica, pero sólo de forma significativa en títulos superiores a 10.000 UI/mL, observados únicamente en muestras de estudios de control post-vacunación; en esta situación, la determinación del HBsAg no está indicada. De hecho, Cunninghan et al. (20) encontraron que sólo el 4,5% de los pools formados con sueros de mujeres embarazadas tenían un título de anti-HBs superior a 7.500 UI/L. Teniendo en cuenta esta limitación a la sensibilidad del método de pooling, encontraron que éste también estaba en torno al 100% de sensibilidad y especificidad. Nuestros resultados podrían ser reproducibles en otras zonas de baja prevalencia, pero deberían demostrarse previamente en zonas de alta endemicidad para el VHB. En estas zonas, la mayoría de la población ya está inmunizada contra este virus, y es posible que los títulos de anti-HBs encontrados en los sueros estén ligeramente elevados.
Rabenau et al. (21) estudiaron la seguridad de las pruebas serológicas en pools de plasma para HBsAg utilizando un sistema EIA similar al nuestro. En su estudio, la detección del HBsAg se vio influida por la presencia de títulos bajos de anti-HBs tras 5 horas de incubación. Sin embargo, tras la disociación del complejo inmune, el HBsAg seguía siendo detectable en el pool incluso en presencia de un alto contenido de anti-HBs. En nuestro estudio demostramos que sólo se produce una disminución significativa de la sensibilidad para títulos de anti-HBs superiores a 10.000 UI/L. Estas diferencias pueden deberse a que en nuestro caso las muestras se analizaron sin incubación previa. Esto podría impedir la neutralización del antígeno por la formación de inmunocomplejos.
Por lo tanto, creemos que, tanto el título de anti-HBs en el suero como el procesamiento previo a la prueba de las muestras con EIA pueden influir en la sensibilidad del método de pooling. Todo laboratorio que desee utilizar esta técnica debería tener en cuenta estos dos factores antes de generalizar su uso.
La OMS recomienda el uso del método de pooling de suero en caso de infección por VIH, cuando la prevalencia de la enfermedad es inferior al 2%, y con un pooling máximo de 5 sueros (25). Siguiendo estas indicaciones, la mayoría de los estudios aplican y recomiendan el uso de técnicas de pooling en zonas de baja seroprevalencia. En nuestro estudio, demostramos que el pooling de sueros también puede ser rentable en poblaciones con una alta prevalencia de portadores de HBsAg. Esto podría permitir su uso en países pertenecientes a zonas de endemicidad media y alta para la infección por el VHB, que en general coincide con los países subdesarrollados o en vías de desarrollo, es decir, aquellos que tienen una mayor necesidad de reducir los costes económicos que suponen las pruebas de laboratorio. No obstante, será necesario realizar estudios similares en estas zonas para confirmar nuestros resultados. Sin embargo, ya se ha demostrado que en países como Kenia, que tiene una alta frecuencia de infección por VIH (7,3%), la aplicación del pooling para su detección permitiría un ahorro económico del 62% sin pérdida significativa de seguridad (14). En España, país perteneciente a un área de baja endemicidad para la infección por el VHB, y con una frecuencia de portadores del HBsAg en la población general del 1,2% (4), puede utilizarse en todos aquellos colectivos en los que el cribado del HBsAg es actualmente obligatorio (como donantes de sangre, sujetos sometidos a programas de autotransfusión, cribado de embarazadas).
El estudio coste-beneficio de la aplicación de las técnicas de detección de portadores crónicos del VHB permite demostrar que el ahorro económico es mayor cuando se realiza en un gran número de determinaciones en colectivos de baja seroprevalencia, y su uso podría ser también coste-efectivo en zonas de alta prevalencia de la infección, e incluso en laboratorios que realicen un número reducido de determinaciones. Hemos demostrado el ahorro de costes económicos en función de las diferentes prevalencias de HBsAg y del número de pruebas a realizar anualmente. En nuestra área, la aplicación del método de pooling podría ahorrar alrededor del 74% de los costes económicos totales en comparación con el método único.
Algunos investigadores han comenzado recientemente a practicar estrategias para la detección de ácidos nucleicos virales en donantes de sangre mediante la reacción en cadena de la polimerasa (PCR) con el fin de aumentar la seguridad que supone la transfusión de derivados sanguíneos (26-29). Debido a que no es posible realizar cribados individuales por problemas económicos y por la cantidad de trabajo que conlleva, actualmente se utiliza el método de agrupación de muestras de sangre serológicamente negativa. Este procedimiento podría aumentar la seguridad de la sangre mediante un cribado sistemático de las donaciones de sangre a un coste relativamente bajo. Dado que una de las principales limitaciones en la práctica de estos métodos es la económica, creemos que, con nuestro estudio, podría haber una base teórica para el uso del cribado de las infecciones por VHB, VHC y VIH en dos fases a un coste económico relativamente bajo. En la primera fase podría aplicarse un EIA comercial a un conjunto de sueros de donantes; en la segunda fase, la aplicación de técnicas de PCR a un conjunto de muestras seronegativas podría aumentar la seguridad del análisis. Hasta que futuros estudios puedan demostrar el valor de esta técnica con donantes de sangre, creemos que sólo podría aplicarse a pruebas diagnósticas y epidemiológicas.
Concluimos que la aplicación de EIA a sueros agrupados es un método sensible y específico en la detección de los dos principales subtipos de HBsAg en un área de baja seroprevalencia. La sensibilidad sólo disminuye cuando existen títulos muy altos de anti-HBs en los sueros agrupados. La técnica de pooling es un método que también puede permitir un ahorro económico si se emplea en el estudio de poblaciones con una alta prevalencia de portadores de HBsAg. Creemos que son necesarios más estudios para confirmar estos hallazgos.
Agradecimientos
Deseamos agradecer a David H. Wallace (miembro de la European Association of Science Editors y del Council of Biological Editors) la traducción al inglés del manuscrito.
1. Maynard JE. Hepatitis B: importancia mundial y necesidad de control. Vaccine 1990; 8 (Supl.): 18s-20s.
2. Margolis HS, Alter MJ, Hadler SC. Hepatitis B: evolución de la epidemiología e implicaciones para su control. Sem Liver Dis 1991; 11: 84-92.
3. Alter MJ, Mast EE. La epidemiología de la hepatitis viral en los Estados Unidos. Gastroenterol Clin North Am 1994; 23: 437-55.
4. Suárez A, Riestra S, Navascués CA, et al. Donantes de sangre con HBsAg positivo en Asturias (España): prevalencia actual y su significado. (Resumen en inglés). Med Clin (Barcelona) 1994; 102: 329-32.
5. Emmanuel JC, Basset MT, Smith HJ, Jacobs JA. Pooling of sera for human immunodeficiency virus (HIV) testing: an economical method for use in developing countries. J Clin Pathol 1988; 41: 582-5.
6. Kline RL, Brothers TA, Brookmeyer R, et al. Evaluation of human immunodeficiency virus seroprevalence in population surveys using pooled sera. J Clin Microbiol 1989; 27: 1449-52.
7. Cahoon-Young B, Chandler A, Livermore T, et al. Sensibilidad y especificidad de sueros agrupados frente a sueros individuales en un estudio de prevalencia de anticuerpos del virus de la inmunodeficiencia humana. J Clin Microbiol 1989; 27: 1893-5.
8. Frosner GG, Dobler G, von Sonnenburg FJ. Reducción de costes de las pruebas no vinculadas para la detección del VIH mediante la investigación de sueros agrupados. AIDS 1990; 4: 73-5.
9. Behets F, Bertozzi S, Kasali M, et al. Successful use of pooled sera to determine HIV-1 seroprevalence in Zaire with development of cost-efficiency models. AIDS 1990; 4: 737-41.
10. Monzon OT, Paladin FJ, Dimaandal E, et al. Relevancia del contenido de anticuerpos y del formato de la prueba en las pruebas de VIH de sueros agrupados. AIDS 1992; 6: 43-8.
11. Tamashiro H, Maskill W, Emmanuel J, et al. Reducing the cost of HIV antibody testing. Lancet 1993; 342: 87-90.
12. Perriens JH, Magazani K, Kapila N, et al. Uso de una prueba rápida y un ELISA para el cribado de anticuerpos del VIH en muestras de suero agrupadas en Lubumbashi, Zaire. J Virol Methods 1993; 41: 213-21.
13. McMahon EJ, Fang C, Layug L, Sandler SG. Pooling blood donor samples to reduce the cost of HIV-1 antibody testing. Vox Sang 1995; 68: 215-9.
14. Verstraeten T, Farah B, Duchateau L, Matu R. Pooling sera to reduce the cost of HIV surveillance: a feasibility study in a rural Kenyan district. Trop Med Int Health 1998; 3: 747-50.
15. Kamel MA, Ghaffar YA, Wasef MA, et al. High HCV prevalence in Egyptian blood donors. Lancet 1992; 340: 427.
16. Neil AGS, Conradie JD. Cribado anti-VHC de bajo coste en donantes de sangre. Lancet 1992; 340: 1096.
17. Fernández E, Riestra S, García S, Rodríguez S. Pruebas de pool para la detección de la infección por el virus de la hepatitis C. J Hepatol 1995; 23: 236.
18. García Z, Taylor L, Ruano A, et al. Evaluación de un método de pooling para el cribado rutinario de anti-HCV en donantes de sangre para disminuir la carga de costes de los bancos de sangre en países en vías de desarrollo. J Med Virol 1996; 49: 218-22.
19. Liu P, Shi ZX, Zhang YC, et al. A prospective study of a serum-pooling strategy in screening blood donors for antibody to hepatitis C virus. Transfusion 1997; 37: 732-6.
20. Cunningham R, Northwood JL, Kelly CD, et al. Cribado prenatal rutinario de la hepatitis B utilizando sueros agrupados: validación y revisión de 10 años de experiencia. J Clin Pathol 1998; 51: 392-5.
21. Rabenau H, Schutz R, Berger A, et al. ¿Hasta qué punto son precisas las pruebas serológicas de grupos de plasma para el antígeno de superficie del virus de la hepatitis B, el virus de la inmunodeficiencia humana 1 y 2, y el virus de la hepatitis C? (resumen en inglés). Infus Transfus 1996; 23: 124-30.
22. Echevarría JE, León P, López JA, et al. Distribución del subtipo de HBsAg entre diferentes poblaciones de portadores de HBsAg en España. Eur J Epidemiol 1995; 11: 39-45.
23. Neill AGS, Conradie JD. Pool tests for hepatitis C virus. Lancet 1994; 343: 738.
24. Liu P, Shi ZX, Zhang YC, Zhang XY. Estudio comparativo de 4 kits EIA para el cribado de anticuerpos contra el virus de la hepatitis C en sueros agrupados. Biomed Environ Sci 1998; 11: 75-80.
25. Recomendaciones para la prueba de anticuerpos contra el VIH en sueros agrupados. WHO Weekly Epidemiol Rec 1991; 44: 316-27.
26. Lefrere JJ, Coste J, Defer C, et al. Screening blood donations for viral genomes: multicenter study of real-time simulation using pooled samples on the model of hepatitis C virus RNA detection. Transfusion 1998; 38: 915-23.
27. Yerly S, Pedrocchi M, Perrin L. The use of polymerase chain reaction in plasma pools for the concomitant detection of hepatitis C virus and HIV type 1 RNA. Transfusion 1998; 38: 908-14.
28. Schottstedt V, Tuma W, Bunger G, Lefevre H. PCR for HBV, HCV and HIV-1 experiences and first results from a routine screening programme in a large blood transfusion service. Biologicals 1998; 26: 101-4.
29. Morandi PA, Schockmel GA, Yerly S, et al. Detección del ARN del virus de la inmunodeficiencia humana tipo 1 (VIH-1) en grupos de sueros negativos para anticuerpos contra el VIH-1 y el VIH-2. J Clin Microbiol 1998; 36: 1534-8.
Deja una respuesta