Los elementos del grupo 13 incluyen los metales de postransición.
El término metales de postransición se refiere a aquellos elementos que son metales posteriores a los metales de transición. Al igual que con el concepto de metaloide, no existe un consenso universal sobre qué es exactamente un metal de postransición. Afortunadamente, en la práctica es menos importante definir con precisión qué es y qué no es un metal de postransición que entender la razón por la que puede ser útil clasificar los elementos como un metal de postransición.
Las principales características de los metales de postransición son que son relativamente ricos en electrones y electronegativos en comparación con lo que clásicamente se considera un metal. A grandes rasgos, esto se traduce en puntos de fusión relativamente más bajos (ya que tienden a ocuparse más niveles de antienlace en la estructura de banda), mayor preferencia por la covalencia y mayor fragilidad que otros metales (debido al enlace direccional resultante). Su riqueza electrónica hace que tiendan a formar cationes blandos.
Se utilizan varios sistemas para clasificar los elementos como pertenecientes a los metales de post-transición. Los principales son:
- Metales que siguen el bloque d. Según esta definición, sólo se incluyen los metales de los grupos 13 y superiores y de las filas 3 y superiores que forman cationes relativamente blandos y ricos en electrones y presentan una covalencia significativa en su enlace. Sin embargo, si se adopta este esquema de forma demasiado rígida, se excluye el Al, ya que técnicamente no sigue el bloque d (y tiene una subcapa (n-1)d sin rellenar) y se excluyen los metaloides, aunque muchos de ellos también forman cationes relativamente blandos y ricos en electrones con subcapa (n-1)d rellena. Otra desventaja de este sistema es que enreda la cuestión de qué elementos deben clasificarse como metales post-transición con la espinosa cuestión de qué elementos deben clasificarse como metales frente a metaloides.
- Metales y metaloides del bloque p. Este sistema tiene la ventaja de enfatizar las propiedades interesantes y únicas de los metales y metaloides del bloque p, así como las continuidades en esas propiedades a través del bloque p. Por consiguiente, se utilizará en las secciones siguientes. Sin embargo, tiene la desventaja de excluir metales como el Zn, Cd y Hg, que forman muchos compuestos en los que el metal tiene una configuración (n-1)d10.
- Los metales que siguen a los elementos de transición en el sentido de formar iones con una cáscara de valencia (n-1)d completamente completa a veces junto con el Al y los metaloides del bloque p. Esta definición añade Zn, Cd y Hg (y a veces Cu, Ag y Au) ya que forman iones con una configuración de electrones de valencia (n-1)d 10 como Zn2+, Cd2+ y Hg2+(y Cu+, Ag+ y Au+). Dado que este capítulo sólo considera los elementos del bloque p para los propósitos de este capítulo este sistema es funcionalmente idéntico al sistema 2.
Cualquiera que sea el esquema de clasificación que uno utilice es a menudo más útil pensar en la clasificación de los elementos como metales de post-transición como una forma de enfatizar las similitudes en las propiedades químicas de un conjunto de elementos que como una forma de enfatizar cómo los metales de post-transición difieren de otros metales. Los metales de postransición no son los únicos que forman cationes blandos o compuestos que se describen mejor como unidos por enlaces covalentes. Como se ha aclarado en las secciones anteriores, incluso los metales alcalinos forman aniones en las circunstancias adecuadas y muchos compuestos de metales se describen mejor en términos de covalencia que de interacciones iónicas. Esto ya era evidente en la química de los metales alcalinotérreos Be y Mg, discutida en la sección anterior. En los capítulos siguientes, el enlace y la reactividad en los complejos de coordinación y los compuestos organometálicos se describirán en gran medida en términos covalentes.
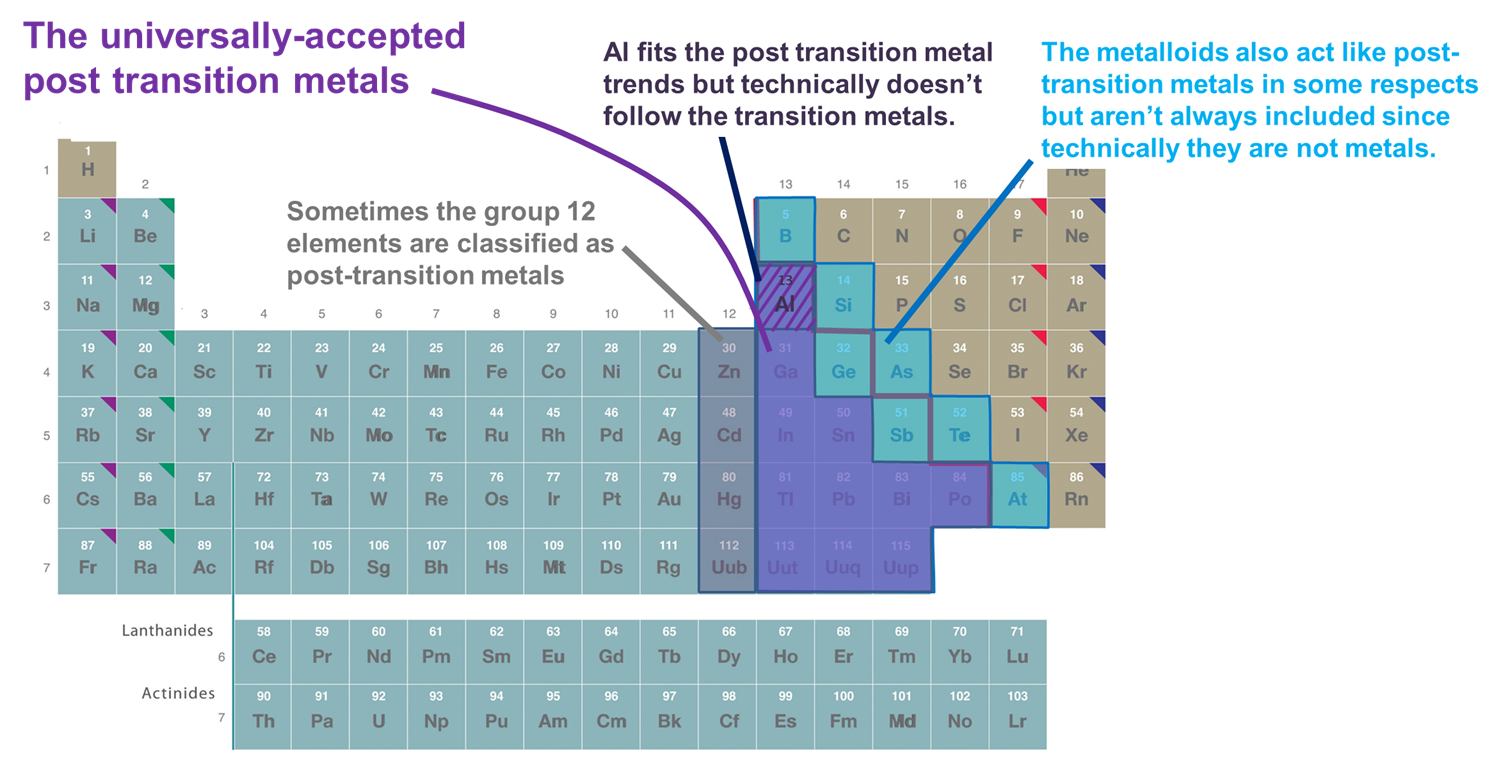
Figura \N (\sf{{PageIndex{2}}). Algunos de los elementos clasificados como metales de post-transición. Los que se muestran en púrpura son comúnmente aceptados ya que son metales y siguen claramente a los metales de transición, mientras que los metales de los grupos 12 (y a veces 11), el Al y los metaloides se incluyen a veces ya que se comportan como los otros metales de postransición en aspectos importantes. La tabla periódica es una adaptación de la que se encuentra en https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atomos%2C_Moléculas%2C_e_Iones/2.5%3A_La_Tabla_Periódica.
Deja una respuesta