Momentos dipolares moleculares
En las moléculas que contienen más de un enlace polar, el momento dipolar molecular no es más que la combinación vectorial de lo que puede considerarse como «momentos dipolares de enlace» individuales. Matemáticamente, los momentos dipolares son vectores; poseen tanto una magnitud como una dirección. El momento dipolar de una molécula es, por tanto, la suma vectorial de los momentos dipolares de los enlaces individuales de la molécula. Si los momentos dipolares de los enlaces individuales se anulan entre sí, no hay momento dipolar neto. Tal es el caso del CO2, una molécula lineal (Figura \(\PageIndex{1a})). Cada enlace C-O del CO2 es polar, pero los experimentos muestran que la molécula de CO2 no tiene momento dipolar. Debido a que los dos dipolos del enlace C-O en el CO2 son de igual magnitud y están orientados a 180° el uno del otro, se cancelan. Como resultado, la molécula de CO2 no tiene un momento dipolar neto aunque tenga una separación sustancial de carga. Por el contrario, la molécula de H2O no es lineal (Figura \(\PageIndex{1b}\)); está doblada en el espacio tridimensional, por lo que los momentos dipolares no se cancelan entre sí. Así, una molécula como el H2O tiene un momento dipolar neto. Esperamos que la concentración de carga negativa esté en el oxígeno, el átomo más electronegativo, y la carga positiva en los dos hidrógenos. Esta polarización de la carga permite al H2O establecer enlaces de hidrógeno con otras especies polarizadas o cargadas, incluidas otras moléculas de agua.
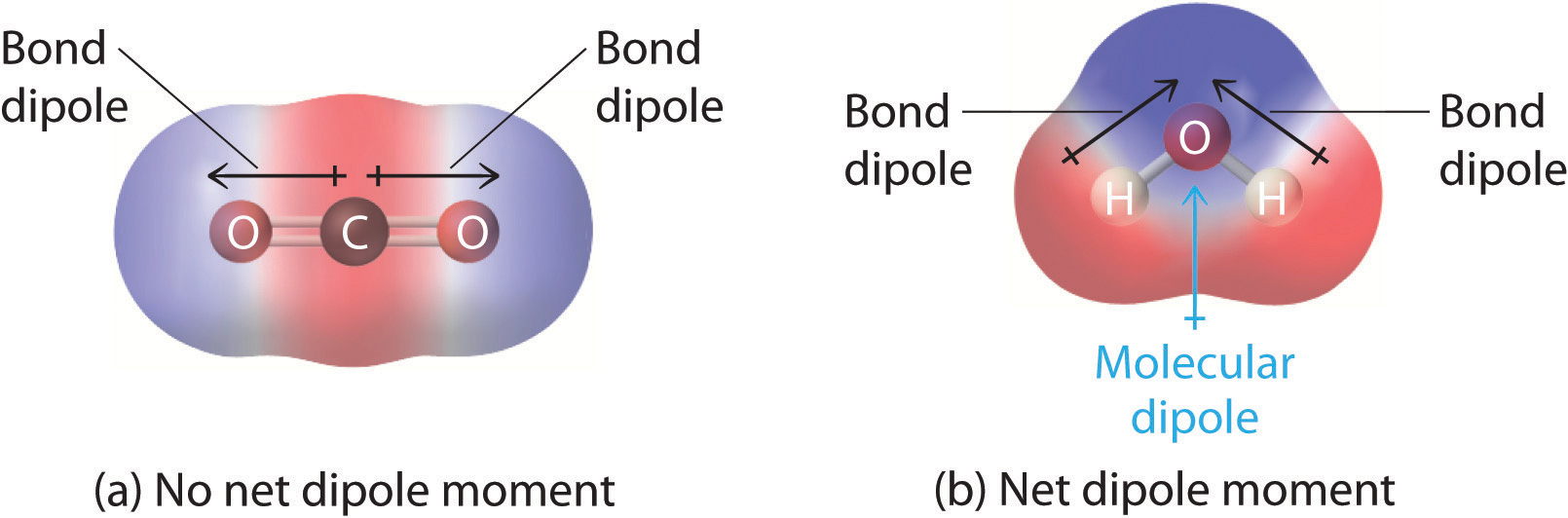
Figura \(\PageIndex{1}): Cómo se suman los momentos dipolares de enlace individuales para dar un momento dipolar molecular global para dos moléculas triatómicas con estructuras diferentes. (a) En el CO2, los dipolos de enlace C-O son de igual magnitud pero están orientados en direcciones opuestas (a 180°). Su suma vectorial es cero, por lo que el CO2 no tiene dipolo neto. (b) En el H2O, los dipolos del enlace O-H también son iguales en magnitud, pero están orientados a 104,5° entre sí. Por lo tanto, la suma vectorial no es cero, y el H2O tiene un momento dipolar neto.
La siguiente es una ecuación simplificada para un sistema simple de dos cargas separadas que está presente en las moléculas diatómicas o cuando se considera un dipolo de enlace dentro de una molécula.
\
Este dipolo de enlace, µ (griego mu) se interpreta como el dipolo de una separación de cargas a lo largo de una distancia \(r\) entre las cargas parciales \(Q^+\) y \(Q^-\) (o los términos más utilizados \(δ^+\) – \(δ^-\)); la orientación del dipolo es a lo largo del eje del enlace. Las unidades de los momentos dipolares suelen ser debyes (D), donde un debye equivale a 3,336 x 1030 coulomb metros (C – m) en unidades del SI. Consideremos un sistema simple de un solo electrón y un protón separados por una distancia fija. La carga unitaria de un electrón es de 1,60 X 1019 C y el electrón del protón & están a 100 pm de distancia (aproximadamente la longitud de un enlace covalente típico), el momento dipolar se calcula como:
\N-(1,60 \Nveces 10^{-19}\N-, C)(1,00 \Nveces 10^{-10} \N-, m) \N- no número \N-, &= 1,60 \Nveces 10^{-29} \C, m, etiqueta 2. \[end{align}]
\N- &= 4.80\N-; D \N-[end{align}\N-]. \end{align}]
(4,80\; D\) es un valor de referencia clave y representa una carga pura de +1 y -1 separada por 100 pm. Sin embargo, si la separación de cargas se incrementara entonces el momento dipolar aumenta (linealmente):
- Si el protón y el electrón estuvieran separados por 120 pm:
\5446>
- Si el protón y el electrón estuvieran separados por 150 pm:
\5446>
- Si el protón y el electrón estuvieran separados por 200 pm:
\5446>
Ejemplo \(\PageIndex{1}\): Agua
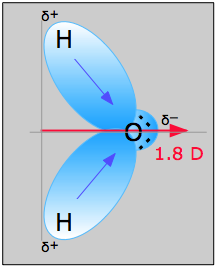
La molécula de agua de la figura \(\PageIndex{1}\) puede utilizarse para determinar la dirección y magnitud del momento dipolar. A partir de las electronegatividades del oxígeno y del hidrógeno, la diferencia es de 1,2e para cada uno de los enlaces hidrógeno-oxígeno. Además, como el oxígeno es el átomo más electronegativo, ejerce una mayor atracción sobre los electrones compartidos; también tiene dos pares solitarios de electrones. De esto se puede concluir que el momento dipolar apunta desde entre los dos átomos de hidrógeno hacia el átomo de oxígeno. Utilizando la ecuación anterior, se calcula que el momento dipolar es de 1,85 D multiplicando la distancia entre los átomos de oxígeno e hidrógeno por la diferencia de carga entre ellos y luego encontrando las componentes de cada uno que apuntan en la dirección del momento dipolar neto (el ángulo de la molécula es de 104.5˚).
El momento de enlace del enlace O-H =1,5 D, por lo que el momento dipolar neto es
\N
Deja una respuesta