Enlace en acetileno
Por último, el concepto de orbital híbrido se aplica bien a los grupos de triple enlace, como los alquinos y los nitrilos. Consideremos, por ejemplo, la estructura del etileno (nombre común acetileno), el alquino más simple.
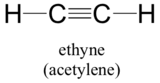
Esta molécula es lineal: los cuatro átomos están en línea recta. El triple enlace carbono-carbono sólo mide 1,20Å. En la imagen del orbital híbrido del acetileno, ambos carbonos están hibridizados. En un carbono sp-hibridizado, el orbital 2s se combina con el orbital 2px para formar dos orbitales híbridos sp que están orientados en un ángulo de 180° con respecto al otro (por ejemplo, a lo largo del eje x). Los orbitales 2py y 2pz permanecen sin hibridar y se orientan perpendicularmente a lo largo de los ejes y y z, respectivamente.


El enlace sigma C-C, entonces, se forma por la superposición de un orbital sp de cada uno de los carbonos, mientras que los dos enlaces sigma C-H se forman por la superposición del segundo orbital sp de cada carbono con un orbital 1s de un hidrógeno. Cada átomo de carbono sigue teniendo dos orbitales 2py y 2pz semillenos, que son perpendiculares entre sí y a la línea formada por los enlaces sigma. Estos dos pares perpendiculares de orbitales p forman dos enlaces pi entre los carbonos, lo que da lugar a un triple enlace en total (un enlace sigma más dos enlaces pi).

El concepto de orbital híbrido explica muy bien otra observación experimental: los enlaces simples adyacentes a los enlaces dobles y triples son progresivamente más cortos y fuertes que los enlaces simples «normales», como el de un alcano simple. El enlace carbono-carbono del etano (estructura A, abajo) es el resultado del solapamiento de dos orbitales sp3.

En el alqueno B, sin embargo, el enlace simple carbono-carbono es el resultado del solapamiento entre un orbital sp2 y un orbital sp3, mientras que en el alquino C el enlace simple carbono-carbono es el resultado del solapamiento entre un orbital sp y un orbital sp3. Todos ellos son enlaces simples, pero el enlace en la molécula C es más corto y fuerte que el de B, que a su vez es más corto y fuerte que el de A.
La explicación aquí es relativamente sencilla. Un orbital sp está compuesto por un orbital s y un orbital p, y por tanto tiene un 50% de carácter s y un 50% de carácter p. Los orbitales sp2, en comparación, tienen un 33% de carácter s y un 67% de carácter p, mientras que los orbitales sp3 tienen un 25% de carácter s y un 75% de carácter p. Debido a su forma esférica, los orbitales 2s son más pequeños y mantienen los electrones más cerca y «apretados» al núcleo, en comparación con los orbitales 2p. En consecuencia, los enlaces que implican un solapamiento sp + sp3 (como en el alquino C) son más cortos y fuertes que los enlaces que implican un solapamiento sp2 + sp3 (como en el alqueno B). Los enlaces que implican solapamiento sp3-sp3 (como en el alcano A) son los más largos y débiles del grupo, debido al carácter 75% ‘p’ de los híbridos.
Deja una respuesta